Hoá học 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
Vậy hiđrocacbon thơm là gì? Chia làm mấy loại? Nó có những ứng dụng nào trong cuộc sống? Để trả lời những câu hỏi trên chúng ta sẽ tìm hiểu một chương mới: Chương 7 Hiđrocacbon thơm - nguồn hiđrocacbon thiên nhiên - hệ thống hóa về hiđrocacbon. Bài đầu tiên chúng ta tìm hiểu trong chương này là Bài 35 Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Benzen và đồng đẳng
a. Đồng đẳng, đồng phân, danh pháp, cấu tạo
Dãy đồng đẳng của benzen
C6H6 (benzen), C7H8 (toluen), C8H10, ... , CnH2n-6 (n ≥ 6, nguyên)
Đồng phân, danh pháp
Đồng phân
C6H6 và C7H8 không có đồng phân hidrocacbon thơm.
- Từ C8H10 trở đi có:
+ Đồng phân vị trí tương đối của các nhóm ankyl
+ Đồng phân cấu tạo mạch cacbon của nhánh
Ví dụ: Đồng phân của C8H10
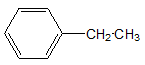
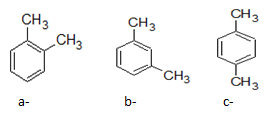
- Đối với nhóm thế có từ 3C trở lên thì các em có thêm đồng phân cấu tạo mạch C của nhánh.
Danh pháp
Tên hệ thống: nhóm ankyl + benzen
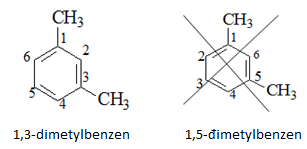
Chú ý: Nếu vòng benzen liên kết với nhiều nhóm ankyl tên gọi: số chỉ vị trí nhánh + tên nhánh + benzen

Cách đánh số các nguyên tử C trong vòng benzen sao cho tổng chỉ số trong tên gọi là nhỏ nhất.
Cấu tạo
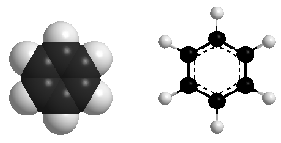
Có 3 liên kết đôi, có cấu trúc lục giác đều.
Cả 6 nguyên tử C và 6 nguyên tử H cùng nằm trên một mặt phẳng.
Có hai cách biểu diễn công thức của benzen:
b. Tính chất vật lí
Các hiđrocacbon thơm đều là chất lỏng hoặc rắn ở điều kiện thường ; ts, tnc tăng theo chiều tăng của phân tử khối.
Hiđrocacbon thơm ở thể lỏng có mùi đặc trưng, không tan trong nước, nhẹ hơn nước, hòa tan được nhiều chất hữu cơ.
c. Tính chất hóa học
Benzen tương đối dễ tham gia phản ứng thế hơn so với các chất oxi hóa. Đó cũng chính là tính chất hóa học đặc trưng chung của các hiđrocacbon thơm nên được gọi là tính thơm
Thế nguyên tử H của vòng benzen
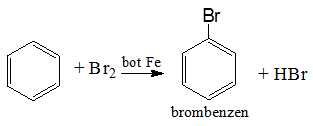
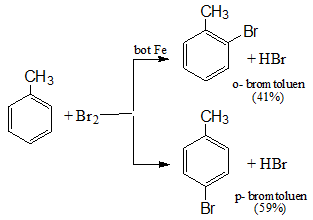
Phản ứng với halogen
Benzen phản ứng thế với brom:
Toluen tác dụng với brom:
Phản ứng với axit nitric:
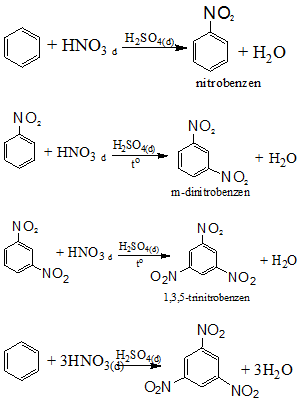
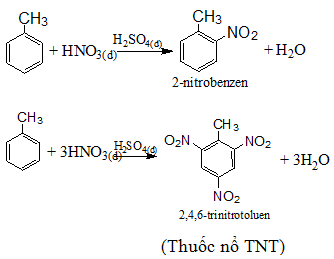
Quy tắc thế ở vòng benzen: khi ở vòng benzen đã có sẵn nhóm ankyl (hay các nhóm –OH, -NH2, -OCH3,...), phản ứng thế vào vòng sẽ dễ dàng hơn và ưu tiên thế vào vị trí o-, p-. Nếu vòng benzen đã có sẵn nhóm –NO2 ( hoặc các nhóm –COOH, -SO3H, ...) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí m-.
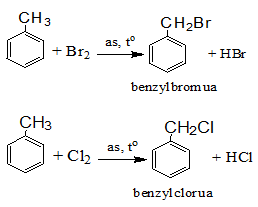
Thế nguyên tử H của mạch nhánh
Phản ứng cộng
Cộng Hidro

Cộng Clo
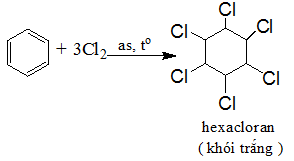
Chú ý: Phản ứng này được dùng để sản xuất thuốc trừ sâu 666 nhưng do chất này có độc tính cao và phân hủy chậm nên ngày nay không được sử dụng.
Phản ứng oxi hóa
Phản ứng oxi hóa không hoàn toàn
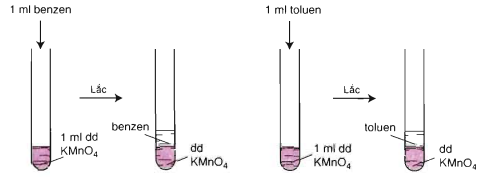
Khi đun nóng hai ống nghiệm trong nồi cách thủy:
Benzen vẫn không làm mất màu dung dịch KMnO4
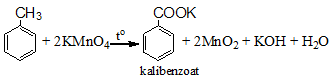
Toluen làm mất màu dung dịch KMnO4 , tạo kết tủa MnO2
Phản ứng oxi hóa hoàn toàn: CnH2n-6 + (3n-3)/2O2 → nCO2 + (n-3)H2O
Nhận xét: Số mol CO2 luôn lớn hơn số mol H2O
1.2. Một số hidrocacbon thơm khác
a. Stiren
- Cấu tạo
Stiren có CTPT: C8H8
Công thức cấu tạo: 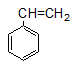
- Tính chất vật lí
Stiren (còn gọi là Vinylbenzen) là chất lỏng, không màu, sôi ở 146oC, không tan trong nước nhưng tan nhiều trong dung môi hữu cơ.
- Tính chất hóa học
Stiren có đặc điểm phần nhánh giống etilen, phần vòng giống benzen. Vì vậy, stiren thể hiện tính chất hóa học giống etilen ở phần mạch nhánh và thể hiện tính chất giống benzen ở phần nhân thơm.
+ Phản ứng cộng
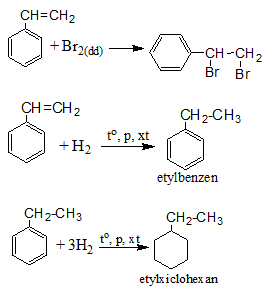
+ Phản ứng trùng hợp
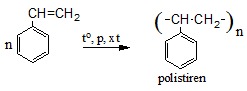
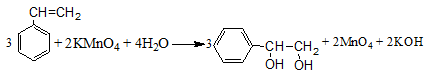
+ Phản ứng oxi hóa
b. Naphtalen
Cấu tạo và tính chất vật lí
Công thức phân tử: C10H8
Công thức cấu tạo: 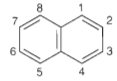
Naphtalen (băng phiến) là chất rắn, nóng chảy ở 80oC, tan trong benzen, ete, ... và có tính thăng hoa.
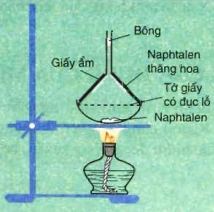
Tính chất hóa học
- Phản ứng thế
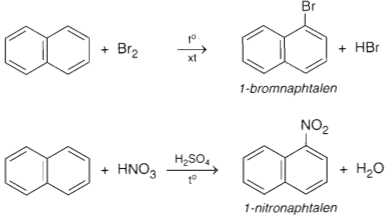
- Phản ứng cộng
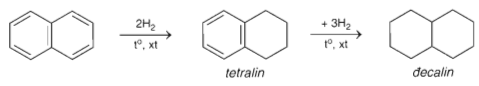
1.3. Một số ứng dụng của hidrocacbon thơm

2. Bài tập minh họa
2.1. Dạng 1: Cách viết đồng phân, gọi tên Benzen và đồng đẳng
Bài 1: Viết thức cấu tạo các hiđrocacbon có công thức cấu tạo sau:
a. 3-etyl-1-isopropylbenzen
b. 1,2-đibenzyleten
c. 2-phenylbutan
Hướng dẫn giải
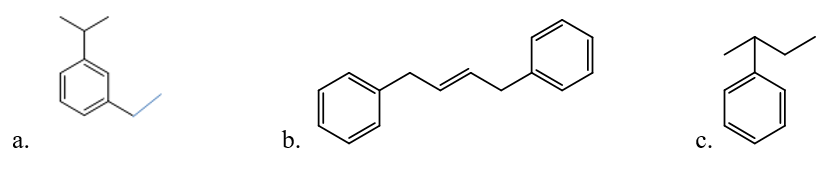
Bài 2: Viết và gọi tên các đồng phân ứng với công thức phân tử C8H10
Hướng dẫn giải
4 đồng phân hiđrocacbon thơm của C8H10 là:

2.2. Dạng 2: Bài tập phản ứng thế của Benzen
Bài 1: Cho 15,6 g C6H6 tác dụng hết với Cl2 (xúc tác bột sắt). Nếu hiệu suất của phản ứng là 80% thì khối lượng clobenzen thu được là bao nhiêu?
Hướng dẫn giải
nC6H6 = 15,6 / 78 = 0,2 mol; mclobenzen = 0,2.0,8. 112,5 = 18 gam
Bài 2: Nitro hóa benzen được 14,1 gam hỗn hợp hai chất nitro có khối lượng phân tử hơn kém nhau 45 đvC. Đốt cháy hoàn toàn hỗn hợp hai chất nitro này được 0,07 mol N2. Tìm hai chất nitro?
Hướng dẫn giải
Phương trình phản ứng:
C6H6 + HNO3 → C6H6-n(NO2)n
C6H6-n(NO2)n + O2 → 6CO2 + (6 - n)/2H2O + n/2N2
Số mol hỗn hợp = 0,14/n
Phân tử khối của hỗn hợp:
M = 14,1/n = 100,7n → 78 + 45n = 100,7n → n = 1,4
Vì hai chất nitro có khối lượng phân tử hơn kém nhau 45 đvC nên CT của 2 hợp chất nitro là: C6H5NO2 và C6H4(NO2)2.
2.3. Dạng 3: Bài tập cách nhận biết, điều chế Benzen và đồng đẳng
Bài 1: Để phân biệt toluen, benzen, stiren chỉ cần dùng dung dịch
A.NaOH
B. HCl
C. Br2
D. KMnO4
Hướng dẫn giải
Benzen không làm mất màu dd thuốc tím ở mọi điều kiện.
Toluen làm mất màu dd thuốc tím trong đk có nhiệt độ: 80-100 độ C
C6H5CH3 + 2KMnO4 → C6H5COOK + KOH + 2MnO2 +H2O
Stiren làm mất màu dd thuốc tím ở đk thường
3C6H5 -CH=CH2 + 2KMnO4 + 4H2O → 3 C6H5-CHOH-CH2OH + 2MnO2 + 2KOH
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Đốt cháy hoàn toàn ankybenzen X thu được 7,84 lít CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của X là?
Câu 2: Đốt cháy hoàn toàn 5,3 gam ankybenzen X thu được 8,96 lít CO2 (đktc). Công thức phân tử của X là?
Câu 3: Cho benzen tác dụng với lượng dư HNO3 đặc có xúc tác H2SO4 đặc để điều chế nitrobenzen. Khối lượng Nitrobenzen điều chế được từ 19,5 tấn benzen (hiệu suất phản ứng 80%) là?
Câu 4: Cho toluen tác dụng với lượng dư HNO3 đặc có xúc tác H2SO4 đặc để điều chế 2,4,6-trinitrotoluen (TNT). KHối lượng điều chế được từ 23 kg toluen (hiệu suất 80%)là?
Câu 5: Chất X là đồng đẳng của benzen, có công thức đơn giản nhất là C3H4. Công thức phân tử của của X là?
3.2. Bài tập trắc nghiệm
Câu 1: Số đồng phân Hiđrocacbon thơm ưng với công thức C8H10 là
A. 4
B. 2
C. 3
D. 5
Câu 2: Benzen tác dụng với Br2 theo tỷ lệ mol 1 : 1 (có mặt bột Fe), thu được sẩn phẩm hữu cơ là
A.C6H6Br2
B. C6H6Br6
C. C6H5Br
D. C6H6Br4
Câu 3: Benzen tác dụng với Cl2 có ánh sáng, thu được hexaclorua. Công thức của hexaclorua là
A.C6H6Cl2
B. C6H6Cl6
C. C6H5Cl
D. C6H6Cl4
Câu 4: Benzen tác dụng với H2 dư có mặt bột Ni xúc tác, thu được
A. hex-1-en
B. hexan
C. 3 hex-1-in
D. xiclohexan
Câu 5: Chất nào sau đây làm mất màu dung dịch KMnO4 ở nhiệt độ thường?
A. benzen
B. toluen
C. 3 propan
D. stiren
3.3. Trắc nghiệm Online
Các em hãy luyện tập bài trắc nghiệm Benzen và đồng đẳng. Một số hiđrocacbon thơm khác Hóa học 11 sau để nắm rõ thêm kiến thức bài học.
4. Kết luận
Sau bài học cần nắm:
- Định nghĩa, công thức chung, đặc điểm cấu tạo, đồng phân, danh pháp. Tính chất vật lí của benzen và đồng đẳng.
- Viết được công thức cấu tạo của benzen và một số chất trong dãy đồng đẳng. Viết được các phương trình hoá học biểu diễn tính chất hoá học của benzen, vận dụng quy tắc thế để dự đoán sản phẩm phản ứng. Xác định công thức phân tử, viết công thức cấu tạo và gọi tên.
