Hóa học 9 Bài 13: Luyện tập chương 1 Các loại hợp chất vô cơ
Các em đã được tìm hiểu tất cả các loại hợp chất vô cơ, cũng như mối quan hệ của chúng. Để củng cố lại các kiến thức đã học về các loại hợp chất vô cơ, vận dụng nó để giải một số bài tập nên hôm nay chúng ta sẽ vào tiết luyện tập.
Mục lục nội dung

1. Tóm tắt lý thuyết
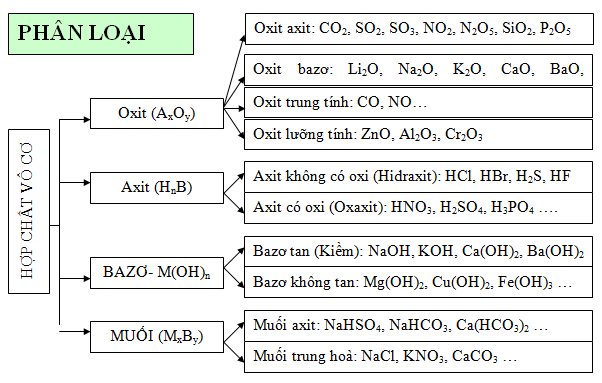
1.1. Phân loại các hợp chất vô cơ
1.2. Tính chất hóa học của các loại hợp chất vô cơ
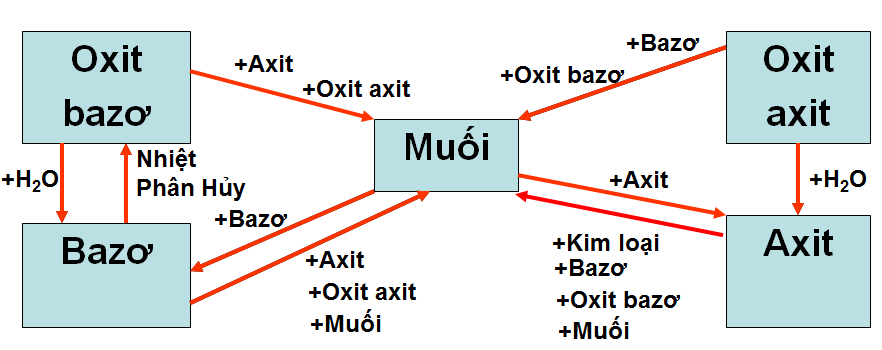
Muối + Muối → 2Muối
Muối + Kim loại → Muối mới + Kim loại mới
Muối \(\xrightarrow{{{t^o}}}\) Chất mới
2. Bài tập minh họa
2.1. Dạng 1: Viết phương trình hóa học tính chất của hợp chất vô cơ
Để một mẫu natri hiđroxit trên tấm kính trong không khí, sau vài ngày thấy có chất rắn màu trắng phủ ngoài. Nếu nhỏ vài giọt dd HCl vào chất rắn trắng thấy có chất khí thoát ra, khí này làm đục nước vôi trong. Chất rắn màu trắng là sản phẩm phản ứng natri hiđroxit với
a) Oxi trong không khí
b) Hơi nước trong không khí
c) Cacbon đioxit và oxi trong không khí
d) Cacbon đioxit và hơi nước trong không khí
e) Cacbon đioxit trong không khí
Hãy chọn câu đúng. Giải thích và viết phương trình hóa học minh họa?
Hướng dẫn giải
Câu đúng là câu e. Cacbon đioxit trong không khí
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
2.2. Dạng 2: Bài tập nhận biết
Bằng phương pháp hóa học nhận biết 4 dung dịch : HCl, MgSO4, MgCl2, NaOH chứa trong 4 lọ mất nhãn.
Hướng dẫn giải
- Đánh dấu mỗi lọ và lấy ra một ít hóa chất để thử.
- Cho giấy quỳ tím lần lượt vào 4 lọ.
- Dung dịch trong lọ nào làm cho giấy quỳ tím:
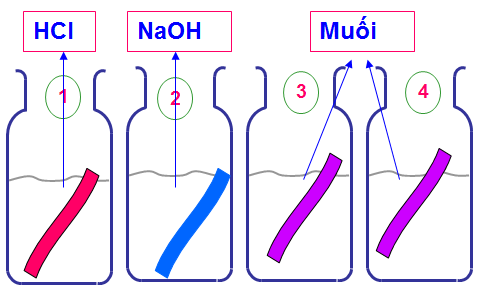
- Dung dịch trong lọ nào làm không làm đổi màu giấy quỳ tím thì lọ đó chứa dung dịch MgSO4, MgCl2
- Nhỏ vài giọt BaCl2 vào hai lọ chứa dung dịch muối. Dung dịch trong lọ nào có hiện tượng kết tủa trắng là MgSO4
BaCl2 + MgSO4 → MgCl2 + BaSO4
- Còn lại MgCl2
2.3. Dạng 3: Xác định các đại lượng theo phương trình hóa học
Trộn một dung dịch có hòa tan 0,2 mol CuCl2 với một dung dịch có hòa tan 20 g NaOH. Lọc hỗn hợp các chất sau phản ứng, được kết tủa và nước lọc . Nung kết tủa đến khi khối lượng không đổi.
a) Viết các phương trình hóa học xảy ra ?
b)Tính khối lượng chất rắn thu được sau phản ứng?
c) Tính khối lương các chất tan có trong nước lọc?
Hướng dẫn giải
a) CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl (1)
0,2mol 0,4mol 0,2mol 0,4mol
Cu(OH)2 → CuO + H2O (2)
0,2mol 0,2mol
b) Ta có:
\(\begin{array}{*{20}{l}}
{{n_{CuC{l_2}}} = 0,2mol} \\
{{m_{NaOH}} = 20gam \Rightarrow {n_{NaCl}} = \frac{{20}}{{40}} = 0,5(mol)}
\end{array}\)
So sánh: \(\frac{{0,2}}{1} < \frac{{0,5}}{2}\) ⇒ Khối lượng NaOH dư
Từ pt (1) và (2) ta có nCuO = 0,2 mol
Vậy khối lượng chất rắn tạo thành sau khi nung là: mCuO = 0,2.80 = 16 gam
c) Các chất tan có trong nước lọc gồm: NaOH dư, NaCl tạo thành
Từ (1) ta có :
nNaOH dư = 0,5 – 0,4 = 0,1 mol
nNaCl = 0,4 mol
Vậy mNaOH dư = 0,1 . 40 = 4 gam
mNaCl = 0,4 . 58,5 = 23,4 gam
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Để phân biệt các dung dịch đựng các lọ riêng biệt, không dán nhãn: MgCl2, AlCl3, FeCl2, KCl có thể dùng phương pháp hóa học nào?
Câu 2: Cho các oxit: P2O5, CO2, SO2, CaO, Na2O
Oxit nào có khả năng tác dụng với nhau? Viết phương trình hóa học.
Câu 3: Cho phương trình hóa học:
Zn + CuSO4 → Cu + ZnSO4
Tính khối lượng Cu bám lên thanh kẽm, khi khối lượng dung dịch tăng 0,2 gam
Câu 4: Cho 31 gam Na2O vào 500 gam dung dịch NaOH 10%. Tính nồng độ % của dung dịch NaOH tạo ra.
Câu 5: Viết các phương trình phản ứng hóa học theo sơ đồ sau:
Na2O → NaOH → Na2SO3 → SO2 → K2SO3
Câu 6: Trung hòa 300ml dung dịch H2SO4 1,5M bằng dung dịch NaOH 40%
a. Tính khối lượng dung dịch NaOH cần dùng.
b. Nếu thay dung dịch NaOH bằng dung dịch KOH 5,6% (D = 1,045g/ml) thì lượng KOH cần dùng là bao nhiêu?
3.2. Bài tập trắc nghiệm
Câu 1: 0,05 mol FeO tác dụng vừa đủ với:
A. 0,02mol HCl
B. 0,1mol HCl
C. 0,05mol HCl
D. 0,01mol HCl
Câu 2: Dãy bazơ nào tương ứng với các oxit sau: Na2O ; CuO ; BaO ; Fe2O3?
A. NaOH ; Cu(OH)2 ; Ba(OH)2 ; Fe(OH)3
B. NaOH ; Cu(OH)2 ; Ba(OH)2 ; Fe(OH)2
C. NaOH ; CuOH ; Ba(OH)2 ; Fe(OH)3
D. NaOH ; CuOH ; Ba(OH)2 ; Fe(OH)2
Câu 3: Để phân biệt 2 ống nghiệm, một ống đựng dung dịch NaOH, một ống đựng dung dịch Ca(OH)2, người ta có thể dùng hóa chất là:
A. Quỳ tím.
B. Quỳ tím ẩm
C. Dung dịch NaOH
D. Khí CO2
4. Kết luận
Sau bài học cần nắm các nội dung:
- Phân loại các loại hợp chất vô cơ.
- Tính chất hóa học của từng loại hợp chất vô cơ.
- Vận dụng vào các bài tập có liên quan.
Tham khảo thêm
- docx Hoá học 9 Bài 1: Tính chất hóa học của oxit và Khái quát về sự phân loại oxit
- docx Hóa học 9 Bài 2: Một số oxit quan trọng
- docx Hóa học 9 Bài 3: Tính chất hóa học của axit
- docx Hóa học 9 Bài 4: Một số axit quan trọng
- docx Hóa học 9 Bài 5: Luyện tập tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 6: Thực hành: Tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 7: Tính chất hóa học của bazơ
- docx Hóa học 9 Bài 8: Một số bazơ quan trọng
- docx Hóa học 9 Bài 9: Tính chất hóa học của muối
- doc Hóa học 9 Bài 10: Một số muối quan trọng
- docx Hóa học 9 Bài 11: Phân bón hóa học
- docx Hóa học 9 Bài 12: Mối quan hẹ giữa các loại hợp chất vô cơ
- docx Hóa học 9 Bài 14: Thực hành: Tính chất hóa học của bazơ và muối
