Hoá học 9 Bài 36: Metan
Metan là một trong những nguồn nhiên liệu quan trọng cho đời sống và cho công nghiệp. Vậy mêtan có cấu tạo, tính chất và ứng dụng như thế nào? Hôm nay các em sẽ được nghiên cứu qua bài giảng về Metan.
Mục lục nội dung

1. Tóm tắt lý thuyết
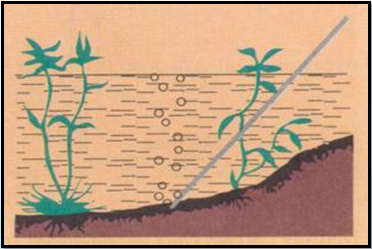
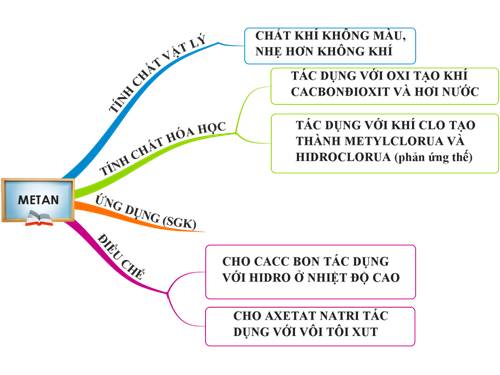
1.1. Trạng thái tự nhiên, tính chất vật lí
-
Trong tự nhiên mêtan có trong mỏ khí thiên nhiên, mỏ dầu, mỏ than, trong bùn ao.
-
Mêtan là chất khí, không màu, không mùi, nhẹ hơn không khí rất ít tan trong nước.
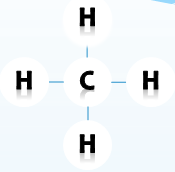
1.2. Cấu tạo phân tử
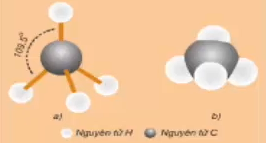
a) Dạng rỗng b) Dạng đặc
-
Giữa nguyên tử C và nguyên tử H chỉ có 1 liên kết những liên kết như vậy gọi là liên kết đơn.
-
Ta thấy trong phân tử mêtan có 4 liên kết đơn.
1.3. Tính chất hóa học
a. Tác dụng với oxi
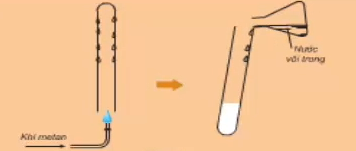
Mêtan cháy tạo thành khí cacbonđioxit và hơi nước
Phương trình phản ứng: CH4 + O2 .PNG)
Chú ý: Hỗn hợp gồm một thể tích metan và hai thể tích oxi là hỗn hợp nổ mạnh.

b. Tác dụng với Clo
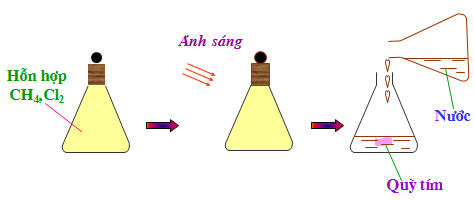
Mêtan đã tác dụng với clo khi có ánh sáng
Phương trình hóa học:
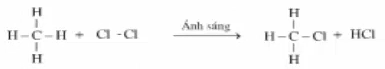
Viết gọn lại là: CH4 +Cl2.PNG)
CH3Cl có tên gọi là metylclorua
Trong phản ứng trên, ntử H của mêtan được thay thế 4 ntử clo, vì vậy phản ứng trên được gọi là phản ứng thế
1.4. Ứng dụng
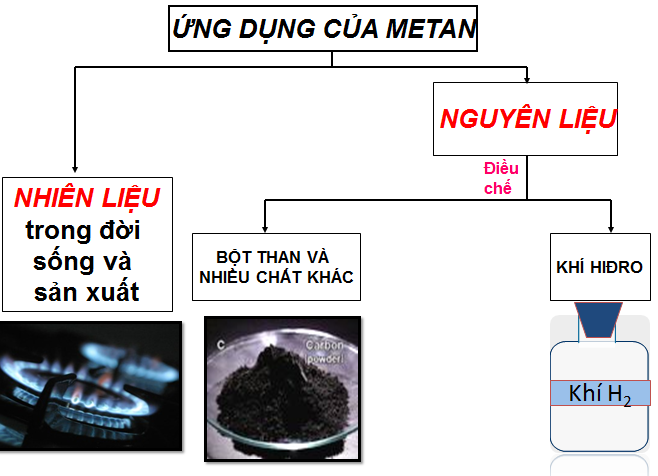
Metan + nước 
1.5. Tổng kết
2. Bài tập tự luận
2.1. Dạng 1: Xác định công thức
Hỗn hợp X gồm CH4 và hiđrocacbon A. Đốt cháy hoàn toàn 4,48 lít hỗn hợp X rồi cho toàn bộ sản phẩm thu được hấp thụ hết vào dung dịch Ca(OH)2 dư thấy tạo ra 50 gam kết tủa và khối lượng bình đựng dung dịch Ca(OH)2 tăng thêm 34,6 gam.
Xác định công thức phân tử của A, biết trong hỗn hợp số mol của A gấp lần số mol của CH4.
Hướng dẫn giải
Ta có:
nX = 4,48 / 22,4 = 0,2 mol
⇒ nCH4 = 0,2 : 4 = 0,05 mol; nA = 0,05.3 = 0,15 mol
Phương trình hóa học: CH4 + 2O2 → CO2 + 2H2O
CnHm + (n+m/4)O2 to→ nCO2 + m/2H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
nCO2 = nCaCO3 = 50 / 100 = 0,5 mol ⇒ nCO2, nH2O tạo ra khi đốt cháy A là
nCO2 = 0,5 - 0,05 = 0,45 mol; nH2O = 0,7 - 0,1 = 0,6 mol
⇒ Công thức của A là C3H8
2.2. Dạng 2: Bài toán phản ứng của metan
Đốt cháy hoàn toàn 11,2 lít khí metan. Hãy tính thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành. Biết thể tích các khí đo ở đktc.
Hướng dẫn giải
Số mol metan là:
\(n_{CH_{4}} = \frac{11,2 }{22,4} = 0,5 \ mol\)
Phương trình hóa học:
CH4 + 2O2 → CO2 + 2H2O
1 mol 2 mol 1 mol
0,5 mol → 1 mol 0,5 mol
Thể tích khí oxi cần dùng là:
VO2 = 1 . 22,4 = 22,4 lít
Thể tích khí cacbonic tạo thành là:
VCO2 = 0,5 . 22,4 = 11,2 lít
2.3. Dạng 3: Phân biệt các khí
Nêu phương pháp hoá học dùng để phân biệt các khí đựng trong các bình riêng biệt sau: Metan, hiđro, oxi.
Hướng dẫn giải
Đốt các khí:
Khí cháy mạnh là khí oxi, khí cháy tạo ra CO2 (nhận được nhờ dung dịch Ca(OH)2) là CH4. Khí còn lại là H2.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Khi cho metan tác dụng với clo có chiếu sáng theo tỉ lệ 1:1 về số mol, người thấy ngoài sản phẩm chính là CH3Cl còn tạo ra một hợp chất X trong phần trăm khối lượng của clo là 83,53%. Hãy xác định công thức phân tử của X.
Câu 2: Propan là hiđrocacbon có tính chất tương tự metan và có công thức phân tử C3H8
a) Viết công thức cấu tạo của propan.
b) Viết phương trình hoá học của phản ứng đốt cháy propan.
c) Viết phương trình hoá học của phản ứng giữa propan và clo khi chiếu sá để tạo ra C3H7Cl.
Câu 3: Trong các khí sau: CH4, H2, Cl2, O2.
a) Những khí nào tác dụng với nhau từng đôi một?
b) Hai khí nào khi trộn với nhau tạo ra hỗn hợp nổ?
Câu 4: Nêu phương pháp hoá học dùng để phân biệt các khí đựng trong các bình riêng biệt sau:
a) Metan, cacbon đioxit, hiđro.
b) Metan, cacbon oxit, hiđro.
3.2. Bài tập trắc nghiệm
Câu 1: Các tính chất vật lí của metan là:
A. Chất lỏng, không màu, tan nhiều trong nước
B. Chất khí, không màu, không mùi, nhẹ hơn không khí, tan ít trong nước
C. Chất khí không màu, tan nhiều trong nước
D. Chất khí, không màu, không mùi, nặng hơn không khí, tan ít trong nước
Câu 2: Trong phòng thí nghiệm có thể thu khí metan bằng cách:
A. Đẩy không khí (ngửa bình)
B. Đẩy axit
C. Đẩy nước (úp bình)
D. Đẩy bazơ
Câu 3: Để chứng minh sản phẩm của phản ứng cháy giữa metan và oxi có tạo thành khí cacbonic ta cho vào ống nghiệm hóa chất nào sau đây:
A. Nước cất
B. Nước vôi trong
C. Nước muối
D. Thuốc tím
4. Kết luận
Sau bài học cần nắm:
- CTPT, CTCT, đặc điểm cấu tạo của mêtan.
- Tính chất vật lí: Trạng thái, màu sắc, tính tan trong nước, tỉ khối so với không khí.
- Tính chất hoá học của CH4: tác dụng được với clo (pứ thế), với oxi (pứ cháy).
- Mêtan được dùng làm nhiên liệu và nguyên liệu trong đời sống và sản xuất.
Tham khảo thêm
- doc Hoá học 9 Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- doc Hoá học 9 Bài 35: Cấu tạo phân tử hợp chất hữu cơ
- doc Hoá học 9 Bài 37: Etilen
- doc Hoá học 9 Bài 38: Axetilen
- doc Hoá học 9 Bài 39: Benzen
- doc Hoá học 9 Bài 40: Dầu mỏ và khí thiên nhiên
- doc Hoá học 9 Bài 41: Nhiên liệu
- doc Hoá học 9 Bài 42: Luyện tập chương 4 Hiđrocacbon - Nhiên liệu
- doc Hoá học 9 Bài 43: Thực hành: Tính chất của Hiđrocacbon
