Hóa học 9 Bài 12: Mối quan hẹ giữa các loại hợp chất vô cơ
Các em đã được nghiên cứu về tính chất hóa học của 4 loại hợp chất vô cơ là Oxit, Axit, Bazơ và Muối. Vậy 4 loại hợp chất này có sự chuyển đổi qua lại với nhau như thế nào? Và điều kiện cho sự chuyển đổi đó là gì? Để biết điều đó chúng ta đi vào bài mới: Mối quan hệ giữa các loại hợp chất vô cơ
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Mối quan hệ giữa các loại chất vô cơ
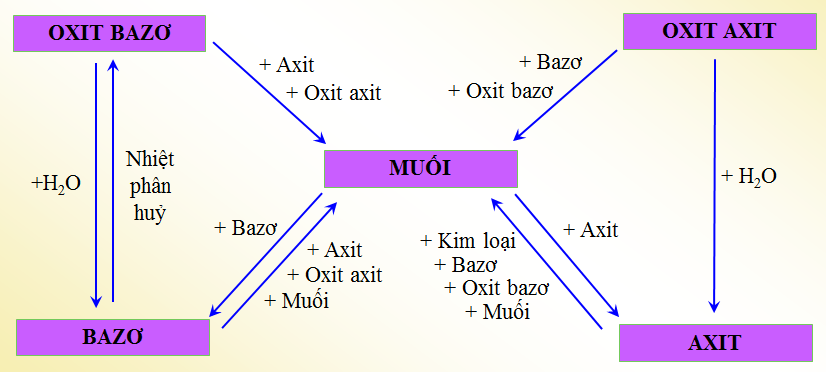
1.2. Những phản ứng hoá học minh họa
1. CaO + 2HCl → CuCl2 +H2O
2. CO2 + 2NaOH → Na2CO3 + H2O
3. K2O + H2O → 2KOH
4. Cu(OH)2 → CuO + H2O
5. SO3 + H2O → H2SO4
6. Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
7. CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
8. AgNO3 + HCl → AgCl + HNO3
9. H2SO4 + ZnO → ZnSO4 + H2O
Lưu ý:
- Một số oxit kim loại như Al2O3, MgO, BaO, CaO, Na2O, K2O … không bị H2, CO khử.
- Các oxit kim loại khi ở trạng thái hoá trị cao là oxit axit như: CrO3, Mn2O7,…
- Các phản ứng hoá học xảy ra phải tuân theo các điều kiện của từng phản ứng.
- Khi oxit axit tác dụng với dd kiềm thì tuỳ theo tỉ lệ số mol sẽ tạo ra muối axit hay muối trung hoà.
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
- Khi tác dụng với H2SO4 đặc, kim loại sẽ thể hiện hoá trị cao nhất, không giải phóng hiđro
Cu + 2H2SO4 → CuSO4 + SO2 + H2SO4
2. Bài tập minh họa
2.1. Dạng 1: Viết phương trình hóa học
Hoàn thành chuỗi phương trình phản ứng sau:
Fe → FeCl2 → Fe(NO3)2 → Fe(OH)2 → FeO
Hướng dẫn giải
\(\begin{array}{*{20}{l}}
{\left( {\text{1}} \right){\text{Fe + 2HCl}} \to {\text{FeC}}{{\text{l}}_{\text{2}}}{\text{ + }}{{\text{H}}_{\text{2}}}} \\
{\left( {\text{2}} \right){\text{FeC}}{{\text{l}}_{\text{2}}}{\text{ + 2AgN}}{{\text{O}}_{\text{3}}} \to {\text{Fe}}{{\left( {{\text{N}}{{\text{O}}_{\text{3}}}} \right)}_{\text{2}}}{\text{ + 2AgCl}}} \\
{\left( {\text{3}} \right){\text{Fe}}{{\left( {{\text{N}}{{\text{O}}_{\text{3}}}} \right)}_{\text{2}}}{\text{ + 2NaOH}} \to {\text{Fe}}{{\left( {{\text{OH}}} \right)}_{\text{2}}}{\text{ + 2NaN}}{{\text{O}}_{\text{3}}}} \\
{\left( {\text{4}} \right){\text{Fe}}{{\left( {{\text{OH}}} \right)}_{\text{2}}}\xrightarrow{{{t^o}}}{\text{FeO + }}{{\text{H}}_{\text{2}}}{\text{O}}}
\end{array}\)
2.2. Dạng 2: Bài tập về tính chất của các hợp chất vô cơ
Ngâm một lá đồng vào dung dịch AgNO3 20%. Sau phản ứng, thu được dung dịch đồng (II) sunfat (CuSO4) và 10,8 gam Ag. Biết AgNO3 phản ứng hết.
a) Viết phương trình phản ứng.
b) Tính khối lượng dung dịch AgNO3 20% đã tham gia phản ứng.
Hướng dẫn giải
Số mol của Ag là:
a) Phương trình phản ứng:
AgNO3 + Cu → CuSO4 + Ag
0,1 0,1
b) Khối lượng dung dịch AgNO3 20% đã tham gia phản ứng là:
\(\begin{gathered}
C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% \hfill \\
\Rightarrow {m_{dd}} = \frac{{{m_{ct}}.100}}{{C\% }} = \frac{{0,1.170.100}}{{20}} = 85\,\,(gam) \hfill \\
\end{gathered} \)
2.3. Dạng 3: Bài tập nhận biết
Chỉ dùng thêm 1 thuốc thử nào để nhận biết được 3 lọ mất nhãn chứa các dung dịch: H2SO4, BaCl2, Na2SO4?
Hướng dẫn giải
Vì Na2CO3 tác dụng với H2SO4 sẽ có hiện tượng sủi bọt khí (khí CO2), tác dụng với BaCl2 sẽ có hiện tượng kết tủa trắng (BaCO3), khi tác dụng với Na2SO4 sẽ không có hiện tượng gì xảy ra.
Phương trình hóa học:
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Có hỗn hợp khí CO và CO2. Nếu cho hỗn hợp này tác dụng với dung dịch Ca(OH)2 dư, sinh ra 1 gam kết tủa trắng. Nếu cho hỗn hợp này tác dụng với CuO dư, nung nóng, thu được 0,64 gam kim loại màu đỏ.
a) Viết các phương trình hoá học.
b) Xác định thành phần phần trăm theo thể tích của hỗn hợp khí.
Câu 2: Dẫn ra những phản ứng hoá học để chứng minh rằng:
a) Từ các đơn chất có thể điều chế hợp chất hoá học.
b) Từ hợp chất hoá học có thể điều chế các đơn chất.
c) Từ hợp chất hoá học này có thể điều chế hợp chất hoá học khác.
Câu 3: Có những chất: Na2O, Na, NaOH, Na2SO4, Na2CO3, NaCl.
a) Dựa vào mối quan hệ giữa các chất, hãy sắp xếp các chất trên thành một dãy chuyển đổi hóa học.
b) Viết các phương trình hóa học cho dãy chuyển đổi hóa học ở câu a.
Câu 4: Cho 1,52 gam hỗn hợp hai kim loại (có hóa trị II) tác dụng hết với dung dịch H2SO4 loãng, dư thấy có 0,336 lít khí thoát ra (ở dktc).
Tính khối lượng hỗn hợp muối sunfat khan thu được (H = 1, S = 32, O = 16).
Câu 5: Có các dung dịch không màu đựng trong các lọ riêng biệt, không dán nhãn gồm: ZnSO4, Mg(NO3)2, Al(NO3)3.Hãy dùng phương pháp hóa học để nhận biết các chất trên.
3.2. Bài tập trắc nghiệm
Câu 1: Sắt (II) oxit không tồn tại được trong:
A. Dung dịch Ca(OH)2
B. Dung dịch Na2SO4
C. Nước
D. Dung dịch H2SO4
Câu 2: Bằng phương pháp nào khẳng định được trong khí oxi có lẫn khí CO2 và khí SO2?
A. Cho khí oxi đi qua dung dịch KCl
B. Cho khí oxi đi qua dung dịch Ca(OH)2
C. Cho khí oxi đi qua dung dịch HCl
D. Cả 3 phương pháp trên đều đúng
Câu 3: Cho các chất có tên gọi sau: Natri oxit, lưu huỳnh đioxit, canxi hiđroxit, axit sunfuric. Dãy công thức hoá học của các chất ứng với tên gọi trên lần lượt là:
A. Na2O ; SO3 ; Ca(OH)2 ; H2SO4
B. Na2O ; SO2 ; Ca(OH)2 ; H2SO4
C. Na2O ; SO2 ; CaO ; H2SO4
D. Na2O ; SO3 ; Ca(OH)2 ; H2SO3
4. Kết luận
Sau bài học cần nắm:
- Oxit, axit, bazơ và muối loại hợp chất này có sự chuyển đổi qua lại với nhau như thế nào?
- Điều kiện cho sự chuyển đổi đó là gì?
Tham khảo thêm
- docx Hoá học 9 Bài 1: Tính chất hóa học của oxit và Khái quát về sự phân loại oxit
- docx Hóa học 9 Bài 2: Một số oxit quan trọng
- docx Hóa học 9 Bài 3: Tính chất hóa học của axit
- docx Hóa học 9 Bài 4: Một số axit quan trọng
- docx Hóa học 9 Bài 5: Luyện tập tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 6: Thực hành: Tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 7: Tính chất hóa học của bazơ
- docx Hóa học 9 Bài 8: Một số bazơ quan trọng
- docx Hóa học 9 Bài 9: Tính chất hóa học của muối
- doc Hóa học 9 Bài 10: Một số muối quan trọng
- docx Hóa học 9 Bài 11: Phân bón hóa học
- docx Hóa học 9 Bài 13: Luyện tập chương 1 Các loại hợp chất vô cơ
- docx Hóa học 9 Bài 14: Thực hành: Tính chất hóa học của bazơ và muối
