Hóa học 9 Bài 24: Ôn tập học kì 1
Bài Ôn tập học kì 1 ôn lại các kiến thức về tính chất của các loại hợp chất vô cơ và kim loại. Vận dụng để giải một số bài tập.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Sự chuyển đổi kim loại thành các hợp chất vô cơ
- Từ kim loại có thể chuyển đổi thành các hợp chất vô cơ như sau:
a. Kim loại → Muối.
Ví dụ: Fe → FeCl2
Fe + 2HCl → FeCl2 + H2
b. Kim loại → Bazơ → Muối(1) → Muối(2)
Ví dụ: Na → NaOH → NaCl → NaNO3
Na + H2O → NaOH + H2
NaOH + HCl → NaCl + H2O
NaCl + AgNO3 → AgCl + NaNO3
c. Kim loại → Oxit bazơ → Bazơ → Muối(1) → Muối(2).
Ví dụ: Ca → CaO → Ca(OH)2 → Ca(NO3)2 → CaSO4
2Ca + O2 .PNG)
CaO + 2H2O → Ca(OH)2 + H2
Ca(OH)2 + Cu(NO3)2 → Cu(OH)2 + Ca(NO3)2
Ca(NO3)2 + Na2SO4 → 2NaNO3 + CaSO4
d. Kim loại → Oxit bazơ → Muối(1) → Bazơ → Muối(2) → Muối(3)
Ví dụ: Cu → CuO → CuCl2 → Cu(OH)2 → CuSO4 → Cu(NO3)2
Cu + O2 .PNG)
CuO + 2HCl → CuCl2 + H2O
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
CuSO4 + Ba(NO3)2 → BaSO4 + Cu(NO3)2
1.2. Sự chuyển đổi các loại hợp chất vô cơ thành kim loại
- Từ các hợp chất vô cơ có thể chuyển đổi thành kim loại như sau:
a. Muối → Kim loại
Ví dụ: CuSO4 → Cu
CuSO4 + Fe .PNG)
b. Muối → Bazơ → Oxit bazơ → Kim loại
Ví dụ: FeCl3 → Fe(OH)3 → Fe2O3 → Fe
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
2Fe(OH)3 .PNG)
Fe2O3 + 3CO .PNG)
c. Bazơ → Muối → Kim loại
Ví dụ: Cu(OH)2 → CuSO4 → Cu
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
CuSO4 + Fe.PNG)
d. Oxit bazơ → Kim loại
CuO → Cu
CuO + H2 .PNG)
1.3. Tổng kết
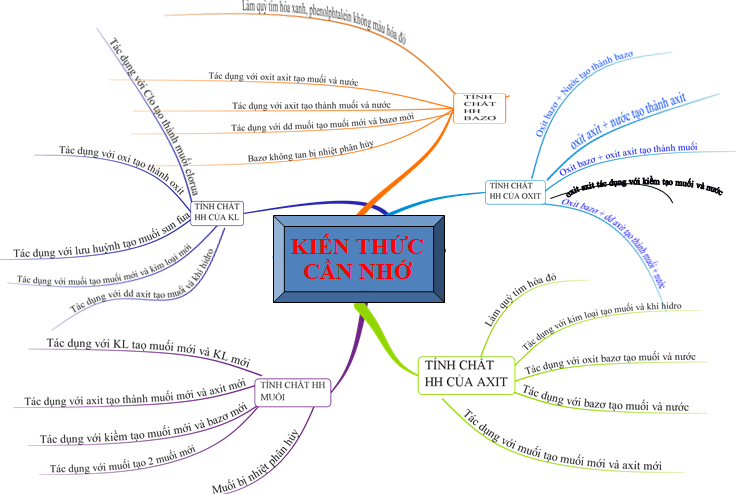
2. Bài tập minh họa
2.1. Dạng 1: Phương trình hóa học tính chất của các chất
Câu 1: Hoàn thành chuổi phản ứng hoá học sau:
Fe -(1)→ FeCl3 -(2)→ Fe(OH)3 -(3)→ Fe2O3 -(4)→ Fe2(SO4)3
(1) 2Fe + 3Cl2 → 2FeCl3
(2) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
(3) 2Fe(OH)3 → Fe2O3 + 3H2O
(4) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Câu 2: Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3Cl2 → 2FeCl3
B. 2CO2 + Ca(OH)2 → Ca(HCO3)2
C. 2NaCl + H2SO4 → Na2SO4 + 2HCl
D. Fe + CuSO4 → FeSO4 + Cu
Hướng dẫn giải
Dung dịch NaCl không phản ứng với dung dịch H2SO4.
Chọn đáp án C.
2.2. Dạng 2: Phân biệt, nhận biết các chất bằng phương pháp vật lý, hóa học
Bằng phương pháp hóa học nhận biết các dung dịch sau: NaOH, H2SO4, Na2SO4, HCl. Viết phương trình hóa học (nếu có).
Hướng dẫn giải
Trích mẫu thử và đánh số thứ tự:
- Nhúng quỳ tím vào 4 mẫu thử:
+ 2 mẫu làm quỳ chuyển đỏ là H2SO4 và HCl
+ Mẫu làm quỳ chuyển xanh là NaOH
+ Mẫu không làm quỳ chuyển màu là là Na2SO4
- Nhỏ dd BaCl2 lần lượt vào 2 mẫu H2SO4 và HCl
+ Mẫu có kết tủa trắng là H2SO4
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
+ Mẫu còn lại là HCl
2.3. Dạng 3: Các bài tập định lượng
Câu 1: Cho m gam hỗn hợp X gồm Fe và Cu vào dung dịch H2SO4 loãng, dư thu được 4,48 lít khí (đktc) và thấy còn 8,8 gam chất rắn không tan. Lấy phần chất rắn không tan ra thu được 250 ml dung dịch Y.
a. Xác định phần trăm về khối lượng các chất trong X.
b. Dung dịch Y tác dụng vừa đủ với BaCl2 thu được 69,9 gam kết tủa. Tính nồng độ mol các chất trong Y.
c. Nếu cho 12 gam X vào 300 ml dung dịch AgNO3 0,8M. Sau một thời gian thu được 28 gam chất rắn Z. Tính khối lượng của Ag có trong Z?
Hướng dẫn giải
- Theo giả thiết ta có:
nH2 = 4,48/22,4 = 0,2 mol
- Phương trình hóa học: Fe + H2SO4 → FeSO4 + H2 (1)
Theo PTHH (1) ta có: nFe = nH2 = 0,2 mol
⇒ mFe = 0,2.56 ⇒ mFe = 11,2 (gam)
Suy ra, giá trị m là: m = 11,2 + 8,8 ⇒ m = 20 (gam)
a. Vậy thành phần phần trăm về khối lượng các chất trong X là:
%mFe = (11.2/20).100 = 56%
và %mCu = 100 - 56 = 44%
b. Theo bài ra dung dịch Y gồm FeSO4 và H2SO4 dư
Phương trình hóa học:
BaCl2 + FeSO4 → BaSO4 + FeCl2 (2)
BaCl2 + H2SO4 → BaSO4 + 2HCl (3)
Theo giả thiết, ta có:
nBaSO4 = 69,9/233 ⇒ nBaSO4 = 0,3 mol
Khi đó theo PTHH (1), (2), (3) ta có:
nFeSO4(Y) = 0,2 mol và nH2SO4(Y) = 0,1 mol
Vậy nồng độ mol các chất trong Y là:
CM FeSO4 = 0,2/0,25 = 0,8 M
Và CM H2SO4 = 0,1/0,25 = 0,4 M
c. Theo giả thiết và kết quả ở phần (a) ta có:
Trong 20 gam X có 0,2 mol Fe và 0,1375 mol Cu
Vậy trong 12 gam X có 0,12 mol Fe và 0,0825 mol Cu
Và nAgNO3 = 0,3.0,8 = 0,24 mol
- Phương trình hóa học có thể:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (4)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag (5)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag (6)
Giả sử chỉ xảy ra phản ứng (4) và phản ứng (4) diễn ra hoàn toàn:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
0,12 0,24 0,12
Chất rắn sau phản ứng gồm Ag: 0,24 mol và Cu 0,0825 mol
mchất rắn = 0,24.108 + 0,0825.64 = 31,2 > mZ = 28.
Vậy điều giả sử là sai. Sau một thời gian để thu được 28 gam chất rắn Z phản ứng (4) mới diễn ra 1 phần. Gọi số mol Fe phản ứng trong (4) là x mol. Ta có:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
x 2x 2x
Sau một thời gian, thu được chất rắn Z gồm: Fe: (0,12 – x) mol; Ag: 2x mol; Cu: 0,0825 mol
Có mZ = 28 gam
→ 56(0,12 – x) + 108.2x + 64.0,0825 = 28 → x = 0,1.
Vậy số mol Ag có trong Z là 0,2 mol.
Khối lượng Ag có trong Z là 0,2.108 = 21,6 gam.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Hãy cho biết hiện tượng xảy ra khi nhúng một viên kẽm vào:
a. Dung dịch CuSO4
b. Dung dịch HCl
Câu 2: Bằng phương pháp hóa học hãy nhận biết dung dịch các chất chứa trong các lọ bị mất nhãn sau: HCl, KOH, NaNO3, Na2SO4
Câu 3: Hãy lập phương trình hóa học của các phản ứng sau:
a. Al + Cl2 →
b. Cu + AgNO3 →
c. Na2O + H2O →
d. FeCl3 + NaOH →
Câu 4: Hoà tan hết 2,3g Na kim loại vào 97,8g nước . Hãy tính nồng độ % của dung dịch thu được sau phản ứng?
3.2. Bài tập trắc nghiệm
Câu 1: Ngâm một lá Zn dư vào 200 ml dung dịch AgNO3 1M. Khi phản ứng kết thúc khối lượng Ag thu được là:
A. 6,5 gam B. 10,8 gam C. 13 gam D. 21,6 gam
Câu 2: Có các chất đựng riêng biệt trong mỗi ống nghiệm sau đây: Al, Fe, CuO, CO2, FeSO4, H2SO4. Lần lượt cho dung dịch NaOH vào mỗi ống nghiệm trên. Dung dịch NaOH phản ứng với:
A. Al, CO2, FeSO4, H2SO4
B. Fe, CO2, FeSO4, H2SO4
C. Al, Fe, CuO, FeSO4
D. Al, Fe, CO2, H2SO4
Câu 3: Kim loại X có những tính chất hóa học sau:
- Phản ứng với oxit khi nung nóng.
- Phản ứng với dung dịch AgNO3.
- Phản ứng với dung dịch H2SO4 loãng giải phóng khí H2 và muối của kim loại hóa trị II. Kim loại X là:
A. Cu B. Fe C. Al D. Na.
Câu 4: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit ?
A . CO2 B. SO2 C. N2 D. O3
Câu 5: Cho 0,1 mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 20,4 B. 1,36 g C. 13,6 g D. 27,2 g
Câu 6: Phản ứng nào dưới đây là phản ứng trao đổi ?
A. 2Na + 2H2O → 2NaOH + H2
B. BaO + H2O → Ba(OH)2
C. Zn + H2SO4 → ZnSO4 + H2
D. BaCl2 + H2SO4 → BaSO4 + 2HCl
Câu 7: Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Câu 8: Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với:
A. Dung dịch NaOH dư
B. Dung dịch H2SO4 loãng
C. Dung dịch HCl dư
D. Dung dịch HNO3 loãng
4. Kết luận
Để ôn tập học kì 1 thật tốt cần nắm các kiến thức sau:
- Tính chất hóa học của : oxit, axit, bazơ, muối, kim loại, phi kim.
- Tính chất hóa học của axit sunfuaric đặc, nhôm, clo.
- Phân bón hóa học.
- Các biện pháp chống ăn mòn kim loại.
- Dãy hoạt động hóa học của kim loại và ý nghĩa của nó.
- Tính chất vật lý của CaO, SO2, H2SO4, NaOH, Al, Fe, Cl2.
- Điều chế: SO2, CaO, H2SO4, NaOH, Al, Cl2.
- Ứng dụng của CaO, NaCl, Al, Fe ( gang- thép).
- Điều kiện để phản ứng xảy ra trong dung dịch.
Tham khảo thêm
- docx Hóa học 9 Bài 15: Tính chất vật lí của kim loại
- docx Hóa học 9 Bài 16: Tính chất hóa học của kim loại
- doc Hóa học Bài 17: Dãy hoạt động hóa học của kim loại
- docx Hóa học 9 Bài 18: Nhôm
- doc Hóa học 9 Bài 19: Sắt
- doc Hóa học 9 Bài 20: Hợp kim sắt: Gang, thép
- doc Hóa học 9 Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- doc Hóa học 9 Bài 22: Luyện tập chương 2 Kim loại
- doc Hoá học 9 Bài 23: Thực hành: Tính chất hóa học của nhôm và sắt
