Hóa học Bài 17: Dãy hoạt động hóa học của kim loại
Mức độ hoạt động hoá học khác nhau của các kim loại được thể hiện như thế nào ? Có thể dự đoán được phản ứng của kim loại với chất khác hay không? Dãy hoạt động hoá học kim loại sẽ giúp em trả lời câu hỏi đó
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Dãy hoạt động hoá học của kim loại được xây dựng như thế nào?
a. Thí nghiệm 1
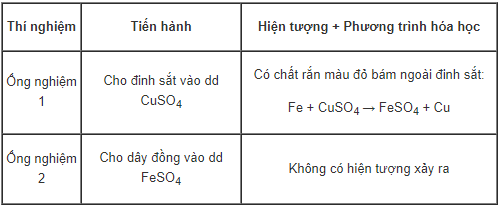
Kết luận: Fe hoạt động hóa học mạnh hơn Cu
b. Thí nghiệm 2
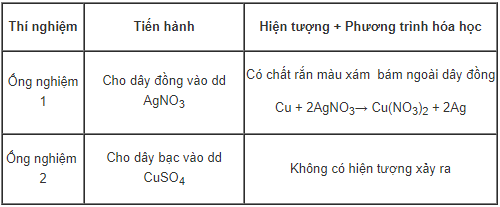
Kết luận: Cu hoạt động hóa học mạnh hơn Ag
c. Thí nghiệm 3
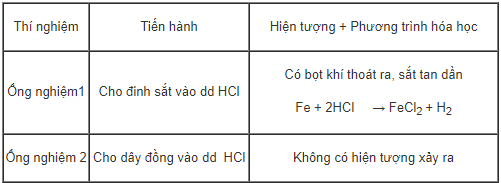
Kết luận: Fe đẩy được hiđro ra khỏi dung dịch axit, Cu không đẩy được hiđro ra khỏi dung dịch axit
d. Thí nghiệm 4
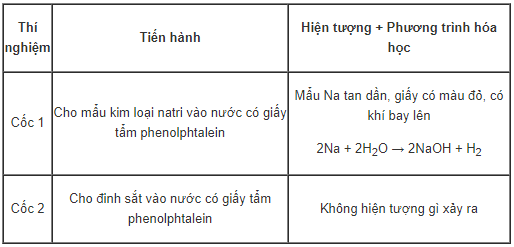
Kết luận: Na hoạt động hóa học mạnh hơn Fe
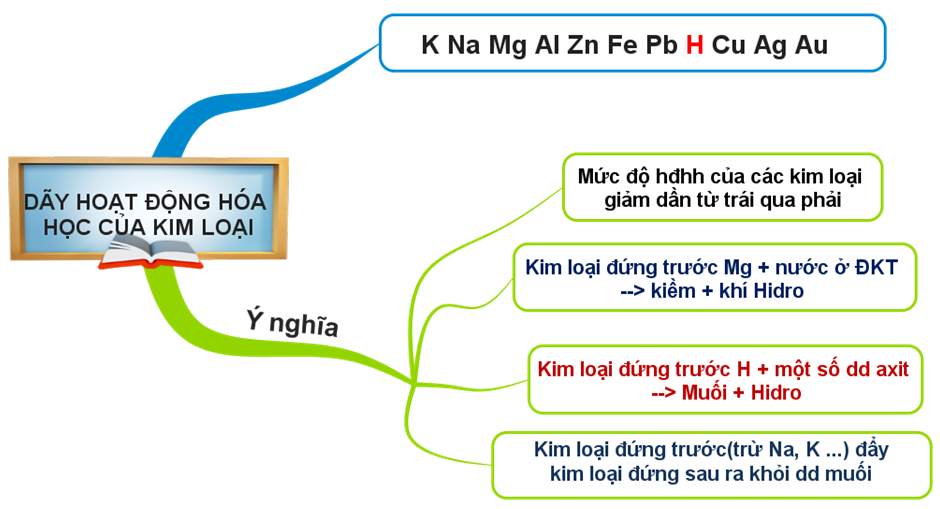
→ Dãy hoạt động hóa học của một số kim loại: K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au
1.2. Dãy hoạt động hóa học của kim loại có ý nghĩa như thế nào?
- Mức độ hoạt động hóa học của các kim loại giảm dần từ trái qua phải.
- Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng khí hiđro.
2Na + 2H2O → 2NaOH + H2
- Kim loại đứng trước H phản ứng với một số axit (HCl, H2SO4 loãng …) giải phóng khí H2
Fe + 2HCl → FeCl2 + H2
- Kim loại đứng trước (trừ K, Na..) đẩy kim loại đứng sau ra khỏi dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
2. Bài tập minh họa
2.1. Dạng 1: Bài tập hỗn hợp kim loại tác dụng với axit
Hoà tan hoàn toàn 8,9 gam hỗn hợp gồm Mg và Zn bằng dung dịch H2SO4 loãng dư thấy thu được 4,48 lít H2 (đktc). Phần trăm số mol của Mg trong hỗn hợp là:
Hướng dẫn giải
Gọi số mol của Mg và Zn lần lượt là x và y (mol)
Ta có phương trình phản ứng như sau:
Mg + H2SO4 → MgSO4 + H2
x → x
Zn + H2SO4 → ZnSO4 + H2
y → y
Ta có khối lượng hỗn hợp Mg và Zn là 8,9 gam nên: 24x + 65y = 8,9
Mặt khác, sau phản ứng thu được 4,48 lít khí nên:
\(\left\{ {\begin{array}{*{20}{l}}
{24x + 65y = 8,9} \\
{x + y = \frac{{4,48}}{{22,4}} = 0,2}
\end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{l}}
{x = 0,1} \\
{y = 0,1}
\end{array}} \right.\)
Phần trăm số mol của Mg trong hỗn hợp là 50% (vì hai số mol của Mg và Zn bằng nhau)
2.2. Dạng 2: Bài tập hỗn hợp kim loại tác dụng với muối
Cho hỗn hợp Al và Fe tác dụng với hỗn hợp dung dịch chứa AgNO3 và Cu(NO3)2 thu được dung dịch B và chất rắn D gồm 3 kim loại. Cho D tác dụng với dung dịch HCl dư, thấy có khí bay lên. Xác định thành phần chất rắn D.
Hướng dẫn giải
Al là kim loại hoạt động hoá học mạnh hơn Fe nên Al phản ứng hết trước.
Trường hợp 1: Al vừa đủ phản ứng, còn Fe không phản ứng và kim loại Ag, Cu được giải phóng.
Al + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
Trường hợp 2: Al phản ứng hết, sau đó đến Fe phản ứng, Fe dư và kim loại Ag, Cu được giải phóng.
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
→ Chất rắn D gồm Ag, Cu và Fe.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho 12,7 gam hợp kim gồm Al, Cu và Mg vào dung dịch HCl dư. Sau phản ứng thu được 11,2 lít khí H2 (ở đktc) và 2,5 gam chất không tan. Xác định thành phần phần trăm khối lượng của hợp kim.
Câu 2: Cho các dung dịch CuSO4, FeSO4, MgSO4, AgNO3 và các kim loại Cu, Fe, Mg, Ag. Theo em những cặp chất nào (kim loại và muối) phản ứng được với nhau ? Viết các phương trình hoá học.
Câu 3: Dung dịch M có chứa CuSO4 và FeSO4.
a) Cho Al vào dung dịch M, sau phản ứng tạo thành dung dịch N chứa 3 muối tan.
b) Cho Al vào dung dịch M, sau phản ứng tạo thành dung dịch N chứa 2 muối tan.
c) Cho Al vào dung dịch M, sau phản ứng tạo thành dung dịch N chứa 1 muối tan.
Giải thích mỗi trường hợp bằng phương trình hoá học.
Câu 4: Cho lá kẽm có khối lượng 25 gam vào dung dịch đồng sunfat. Sau khi phản ứng kết thúc, đem tấm kim loại ra rửa nhẹ, làm khô cân được 24,96 gam.
a) Viết phương trình hoá học.
b) Tính khối lượng kẽm đã phản ứng.
c) Tính khối lượng đồng sunfat có trong dung dịch.
3.2. Bài tập trắc nghiệm
Câu 1: Cho dây nhôm vào trong ống nghiệm chứa dung dịch nào sẽ có phản ứng hóa học xảy ra ?
A. ZnSO4
B. Na2SO4
C. MgSO4
D. K2SO4
Câu 2: Dung dịch FeSO4 có lẫn CuSO4 , dùng kim loại nào để làm sạch dung dịch?
A. Al
B. Fe
C. Cu
D. Zn
Câu 3: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học giảm dần:
A. Na, Mg, Zn
B. Al, Zn, Na
C. Mg, Al, Na
D. Pb, Ag, Mg
4. Kết luận
Sau bài học cần nắm:
- Vận dụng ý nghĩa dãy hoạt động hoá học của kim loại để dự đoán kết quả phản ứng của kim loại cụ thể với dd axit, với nước và với dd muối.
- Tính khối lượng của kim loại trong phản ứng, thành phần phần trăm về khối lượng của hỗn hợp 2 kim loại.
Nội dung bài học được tóm tắt theo sơ đồ sau:
Tham khảo thêm
- docx Hóa học 9 Bài 15: Tính chất vật lí của kim loại
- docx Hóa học 9 Bài 16: Tính chất hóa học của kim loại
- docx Hóa học 9 Bài 18: Nhôm
- doc Hóa học 9 Bài 19: Sắt
- doc Hóa học 9 Bài 20: Hợp kim sắt: Gang, thép
- doc Hóa học 9 Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- doc Hóa học 9 Bài 22: Luyện tập chương 2 Kim loại
- doc Hoá học 9 Bài 23: Thực hành: Tính chất hóa học của nhôm và sắt
- doc Hóa học 9 Bài 24: Ôn tập học kì 1
