Hoá học 9 Bài 38: Axetilen
Axetilen là một hiđrocacbon có nhiều ứng dụng trong thực tiễn. Vậy axetilen có công thức cấu tạo, tính chất và ứng dụng như thế nào? Chúng ta cùng nhau tìm hiểu qua bài giảng về Axrtilen ngày hôm nay.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Tính chất vật lí
Chất khí không màu, không mùi, ít tan trong nước, nhẹ hơn không khí (\(d = \frac{{26}}{{29}}\))
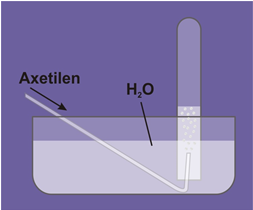
1.2. Công thức cấu tạo
- Công thức cấu tạo của axetilen: H – C ≡ C – H
- Viết gọn: CH ≡ CH
- Trong phân tử C2H2 có liên kết ba (C ≡ C). Có 2 liên kết kém bền dễ đứt lần lược trong các phản ứng hoá học.
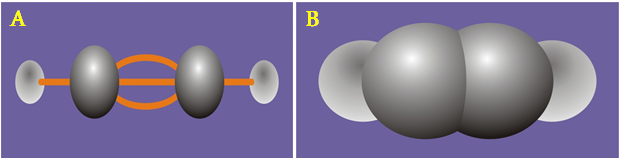
a) Dạng rỗng b) Dạng đặc
1.3. Tính chất hóa học
a. Phản ứng cháy của axetilen
2C2H2 + 5O2 .PNG)
b. Axetilen làm mất màu dung dịch nước Brom
CH ≡ CH + Br – Br → Br – CH = CH – Br
Sản phẩm sinh ra có liên kết đôi trong phân tử nên có thể ccng tiếp với 1 phân tử Br2 nữa
Br – CH = CH – Br + Br – Br → Br2CH – CHBr2
Trong điều kiện thích hợp C2H2 cũng có phản ứng cộng với H2 và một số chất khác
1.4. Ứng dụng
Nhiên liệu trong đèn xì oxi-axetilen, là nguyên liệu để sản xuất PVC, cao su, axit axêtic và nhiều hoá chất khác

1.5. Điều chế
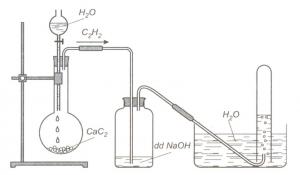
Cho CaC2 phản ứng với nước: CaC2 + 2H2O → C2H2 + Ca(OH)2
Phương pháp hiện đại là nhiệt phân CH4 ở nhiệt độ cao
1.6. Tổng kết
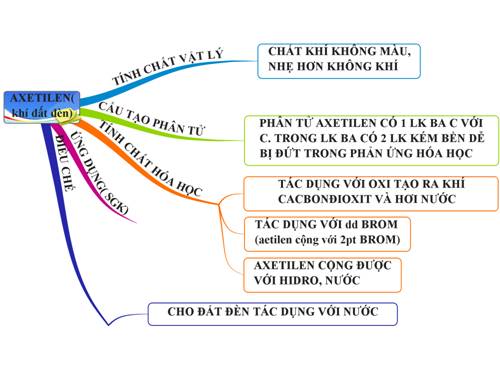
2. Bài tập minh họa
2.1. Dạng 1: Xác định công thức phân tử
Hỗn hợp X gồm hai hiđrocacbon A, B mạch hở, trong phân tử A có 1 liên kết đôi, trong phân tử B có 1 liên kết ba. Cho 0,672 lít hỗn hợp X qua dung dịch Br2 dư thấy lượng brom tham gia phản ứng là 6,4 gam. Nếu đốt cháy 6,72 lít hỗn hợp X sẽ thu được 30,8 gam khí CO2. Xác định công thức phân tử và thành phần phần trăm thể tích của A, B trong hỗn hợp X.
Hướng dẫn giải
Gọi công thức của A là CaH2a của B là CnH2n-2 với a, n > 2, số mol tương ứng cũng là x, y.
Phương trình hóa học:
CnH2n-2 + 2Br2 → CnH2n-2Br4
\(\left\{ \begin{array}{l}
x + y = \frac{{0,672}}{{22,4}} = 0,037\\
n{H_2} = x + 2y = 0,04
\end{array} \right. \to \left\{ \begin{array}{l}
x = 0,02\\
y = 0,01
\end{array} \right.\)
Ta có:
0,2a + 0,1n = 30,8 : 44 = 0,7
→ 2a + m = 7 ⇒ a = 2; n = 3
Công thức của A là C2H4 của B là C3H4
%VC2H4 = (0,2/0,3) . 100% = 66,67%
%VC3H4 = 33,33%
2.2. Dạng 2: Phương trình hóa học
Viết phương trình hoá học phản ứng cháy của các chất sau: CH4, C2H4, C2H2
Tính tỉ lệ giữa số mol H2O và số mol CO2 sinh ra trong mỗi trường hợp.
Hướng dẫn giải
Tỉ lê số mol H2O và CO2 sinh ra khi đốt cháy CH4 là nH2O/nCO2 = 2
Tỉ lệ số mol H2O và CO2 sinh ra khi đốt cháy C2H4 là: nH2O/nCO2 = 1
Tỉ lệ số mol H2O và CO2 sinh ra khi đốt cháy C2H2 là: nH2O/nCO2 = 1/2
2.3. Phân biệt các khí
Nhận biết các lọ khí mất nhãn: N2, H2, CH4, C2H2, C2H4
Hướng dẫn giải
- Lấy mỗi khí một ít làm mẫu thử.
- Dẫn lần lượt các khí đi qua dd AgNO3/NH3. Khí nào tạo được kết tủa vàng là C2H2.
C2H2 + Ag2O → AgC≡CAg ↓ + H2O
- Dẫn các khí còn lại qua dd nước Brom (màu nâu đỏ). Khí nào làm nhạt màu nước brom là C2H4.
H2C=CH2 + Br2 → BrH2C-C2Br
- Lần lượt đốt cháy 3 khí còn lại. Khí không cháy là N2. Sản phẩm cháy của hai khí kia được dẫn qua dd nước vôi trong. Sản phẩm cháy nào làm đục nước vôi trong là CH4. Mẫu còn lại là H2.
CH4 + 2O2 → CO2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ +H2O
H2 + ½ O2 → H2O
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Đốt cháy hoàn toàn một hỗn hợp gồm C2H2 và C2H4 có thể tích 6,72 lít (đktc) rồi cho toàn bộ sản phẩm thu được hấp thụ hết vào dung dịch Ca(OH)2 dư. Sau khi phản ứng kết thúc, thấy khối lượng bình đựng Ca(OH)2 tăng thêm 33,6 gam đồng thời có m gam kết tủa. Xác định thành phần % thể tích của mỗi chất trong hỗn hợp và tính m.
Câu 2: Cho 0,56 lít (đktc) hỗn hợp khí gồm C2H4, C2H2 tác dụng hết với dung dịch brom dư, lượng brom đã tham gia phản ứng là 5,6 gam.
a) Hãy viết phương trình hóa học.
b) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
Câu 3: A là hiđrocacbon mạch hở, trong phân tử có 1 liên kết ba. Khi cho 4 gam tác dụng với dung dịch brom dư thấy lượng brom đã tham gia phản ứng là 32 gam. Hãy xác định công thức phân tử của A.
Câu 4: Xác định công thức phân tử của hiđrocacbon A, biết rằng khi đốt cháy người ta nhận thấy tỉ lệ số mol chất A với số mol CO2 và H2O là 1 : 2 : 1.
Câu 5: Trình bày cách tách riêng từng khí ra khỏi hỗn hợp khí gồm CH4, C2H4, C2H2 và CO2
3.2. Bài tập trắc nghiệm
Câu 1: Có các hiđrocacbon sau: CH2=CH2 , CH≡CH, CH2=CH-CH=CH2 , CH3-CH=CH2. số chất tác dụng với Br2 theo tỉ lệ về số mol 1:2 là :
A. 1
B. 2
C. 3
D. 4
Câu 2: Để thu axetilen tinh khiết từ hỗn hợp C2H2 có lẫn CO2, SO2 người ta cho hỗn hợp
A. qua dung dịch NaOH dư.
B. qua dung dịch brom dư.
C. qua dung dịch KOH dư, sau đó qua H2SO4 đặc.
D. lần lượt qua bình chứa dung dịch brom và dung dịch H2SO4 đặc.
Câu 3: Trong điều kiện nhiệt độ áp suất không đổi thì axetilen phản ứng với oxi theo tỉ lệ thể tích là
A. 2 lít khí C2H2 phản ứng với 4 lít khí O2.
B. 2 lít khí C2H2 phản ứng với 5 lít khí O2.
C. 3 lít khí C2H2 phản ứng với 2 lít khí O2.
D. 3 lít khí C2H2 phản ứng với 1 lít khí O2.
Câu 4: Trong phân tử axetilen, giữa 2 nguyên tử cacbon có:
A. một liên kết đơn.
B. một liên kết đôi.
C. một liên kết ba.
D. hai liên kết đôi.
4. Kết luận
Sau bài học cần nắm:
- CTPT, CTCT, đặc điểm cấu tạo của axêtilen.
- Tính chất vật lí: Trạng thái, màu sắc, tính tan trong nước, tỉ khối so với không khí. Tính chất hoá học của C2H2: Phản ứng cộng với dd Br2, pứ cháy.
- Axetylen được dùng làm nhiên liệu và nguyên liệu trong công nghiệp.
Tham khảo thêm
- doc Hoá học 9 Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- doc Hoá học 9 Bài 35: Cấu tạo phân tử hợp chất hữu cơ
- doc Hoá học 9 Bài 36: Metan
- doc Hoá học 9 Bài 37: Etilen
- doc Hoá học 9 Bài 39: Benzen
- doc Hoá học 9 Bài 40: Dầu mỏ và khí thiên nhiên
- doc Hoá học 9 Bài 41: Nhiên liệu
- doc Hoá học 9 Bài 42: Luyện tập chương 4 Hiđrocacbon - Nhiên liệu
- doc Hoá học 9 Bài 43: Thực hành: Tính chất của Hiđrocacbon
