Hóa học 9 Bài 7: Tính chất hóa học của bazơ
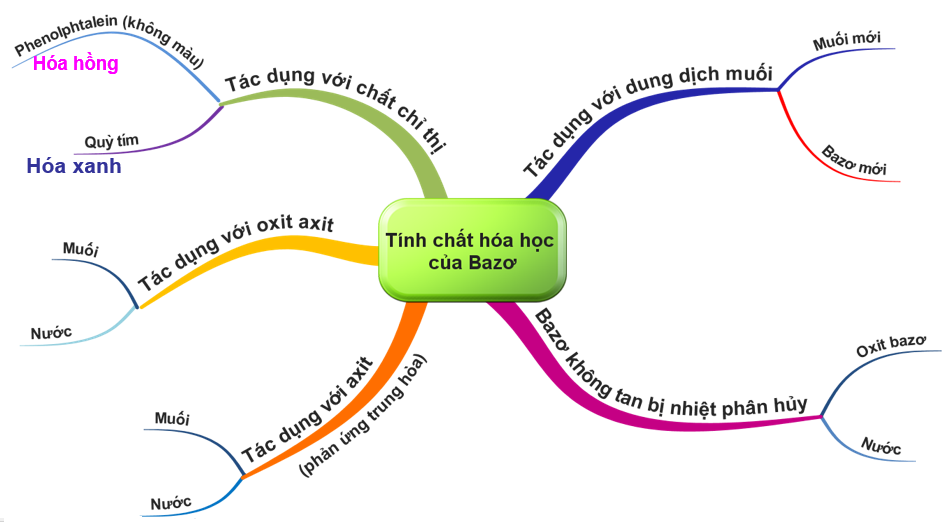
Nội dung bài học chủ yếu đề cập đến tính chất hoá học chung của bazơ (tác dụng với chất chỉ thị màu, và với axit); tính chất hoá học riêng của bazơ tan (kiềm) (tác dụng với oxit axit và với dung dịch muối); tính chất riêng của bazơ không tan trong nước (bị nhiệt phân huỷ).
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Tác dụng với chất chỉ thị
- Quỳ tím hóa xanh.
- Phenolphtalein không màu thành đỏ.
1.2. Tác dụng với oxit axit
Oxit axit tác dụng với dung dịch bazơ tạo thành muối và nước.
CO2 + Ca(OH)2 → CaCO3 (kết tủa trắng) + H2O
Ca(OH)2 + SO2 → CaSO3 + H2O
6KOH + P2O5 → 2K3PO4 + 3H2O
1.3. Tác dụng với axit
H2SO4l + Cu(OH)2 → CuSO4 + 2H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Ba(OH)2 + 2HNO3→ Ba(NO3)2 + 2H2O
1.4. Bazơ không tan bị nhiệt phân huỷ
Cu(OH)2 CuO + H2O
Màu xanh Màu đen
2. Bài tập minh họa
2.1. Dạng 1: Viết phương trình hóa học của bazơ
Có những bazơ sau: NaOH, Cu(OH)2, Ba(OH)2. Hãy cho biết những bazơ nào: (viết phương trình hóa học minh họa nếu có)
a) Tác dụng được với dd HCl?
b) Bị nhiệt phân hủy?
c) Tác dụng được với CO2?
d) Đổi màu quì tím thành xanh?
Hướng dẫn giải
a) Tác dụng được với dd HCl: NaOH, Cu(OH)2, Ba(OH)2
2NaOH (dd) + 2HCl (dd) → 2NaCl (dd) + H2O (l)
Cu(OH)2 (dd) + 2HCl (dd) → CuCl2 (dd) + 2H2O (l)
Ba(OH)2 (dd) + 2HCl (dd) → FeCl2 (dd) + 2H2O (l)
b) Bị nhiệt phân hủy: Cu(OH)2
Cu(OH)2 (r) CuO (r) + H2O (h)
c) Tác dụng được với CO2: NaOH, Ba(OH)2
2NaOH (dd) + CO2 (k) → Na2CO3 (dd) + H2O (l)
Ba(OH)2 (dd) + CO2 (k) → BaCO3 (dd) + H2O (l)
d) Đổi màu quì tím thành xanh: NaOH, Ba(OH)2
2.2. Dạng 2: Bài tập nhận biết
Bằng phương pháp hoá học hãy nhận biết các dung dịch sau: HCl, NaOH, Na2SO4, NaCl.
Hướng dẫn giải
Trích các mẫu thử để nhận biết
- Dùng quì tím nhận biết HCl vì làm quì tím hoá đỏ, NaOH làm quì tím hoá xanh, Na2SO4 và NaCl không làm đổi màu quì tím.
- Dùng dung dịch BaCl2 để nhận biết 2 dung dịch không làm đổi màu quì tím Na2SO4 phản ứng tạo kết tủa trắng, NaCl không phản ứng.
BaCl2 + Na2SO4 → BaSO4 trắng + 2NaCl
2.3. Dạng 3: Bazơ tác dụng với các chất
Cần bao nhiêu ml dung dịch NaOH 0,75M để trung hoà 400ml hỗn hợp dung dịch axit gồm H2SO4 0,5M và HCl 1M.
Hướng dẫn giải
Đổi 400ml thành 0,4 lít
Số mol mỗi axit là:
nH2SO4 = CM.V = 0,4.0,5 = 0,2 (mol)
nHCl = CM.V = 0,4.1 = 0,4 (mol)
Phương trình phản ứng:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,2 → 0,4 (mol)
HCl + NaOH → NaCl + H2O
0,4 → 0,4 (mol)
Số ml dung dịch NaOH 0,75M cần để trung hòa lượng axit trên là:
CM = n.V⇒ V = n.CM = 0,4 + 0,4.0,75 = 1,07 (lit)
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Hãy viết công thức hoá học của các
a) bazơ ứng với những oxit sau: Na2O, BaO, Al2O3, Fe2O3.
b) oxit ứng với những bazơ sau: KOH, Ca(OH)2, Zn(OH)2, Cu(OH)2.
Câu 2: Cho 15,5 gam natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu được.
b) Tính thể tích dung dịch H2SO4 20% có khối lượng riêng 1,14 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
Câu 3: Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2, NaOH, Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học? Viết các phương trình hóa học.
3.2. Bài tập trắc nghiệm
Câu 1: Dung dịch làm phenolphtalein không màu thành màu hồng là:
A. H2SO4
B. NaCl
C. Ca(OH)2
D. K2SO4
Câu 2: Chỉ dùng nước có thể nhận biết chất rắn nào trong 4 chất rắn sau đây:
A. Zn(OH)2
B. Fe(OH)2
C. NaOH
D. Al(OH)3
Câu 3: Chất khí sẽ không bị giữ lại khi cho qua dung dịch Ca(OH)2 là:
A. CO2
B. O2
C. SO2
D. Cả A , B và C
Câu 4: Dung dịch KOH phản ứng với dãy oxit:
A. CO2; SO2; P2O5; Fe2O3
B. Fe2O3; SO2; SO3; MgO
C. P2O5; CO2; Al2O3 ; SO3
D. P2O5 ; CO2; CuO; SO3
Câu 5: Dãy các bazơ bị nhiệt phân huỷ tạo thành oxit bazơ tương ứng và nước:
A. Cu(OH)2 ; Zn(OH)2; Al(OH)3; Mg(OH)2
B. Cu(OH)2 ; Zn(OH)2; Al(OH)3; NaOH
C. Fe(OH)3; Cu(OH)2; KOH; Mg(OH)2
D. Fe(OH)3; Cu(OH)2; Ba(OH)2; Mg(OH)2
4. Kết luận
Sau bài học cần nắm:
- Tính chất hoá học chung của bazơ (tác dụng với chất chỉ thị màu, và với axit)
- Tính chất hoá học riêng của bazơ tan (kiềm) (tác dụng với oxit axit và với dung dịch muối); tính chất riêng của bazơ không tan trong nước (bị nhiệt phân huỷ).
Tham khảo thêm
- docx Hoá học 9 Bài 1: Tính chất hóa học của oxit và Khái quát về sự phân loại oxit
- docx Hóa học 9 Bài 2: Một số oxit quan trọng
- docx Hóa học 9 Bài 3: Tính chất hóa học của axit
- docx Hóa học 9 Bài 4: Một số axit quan trọng
- docx Hóa học 9 Bài 5: Luyện tập tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 6: Thực hành: Tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 8: Một số bazơ quan trọng
- docx Hóa học 9 Bài 9: Tính chất hóa học của muối
- doc Hóa học 9 Bài 10: Một số muối quan trọng
- docx Hóa học 9 Bài 11: Phân bón hóa học
- docx Hóa học 9 Bài 12: Mối quan hẹ giữa các loại hợp chất vô cơ
- docx Hóa học 9 Bài 13: Luyện tập chương 1 Các loại hợp chất vô cơ
- docx Hóa học 9 Bài 14: Thực hành: Tính chất hóa học của bazơ và muối
