Hoá học 9 Bài 29: Axit cacbonic và muối cacbonat
Nội dung bài học Axit cacbonic và muối cacbonat tìm hiểu H2CO3, muối cacbonat về trạng thái và tính chất đặc trưng, ứng dụng và chu trình cacbon trong tự nhiên
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Axit cacbonic (H2CO3)
a. Trạng thái tự nhiên và tính chất vật lí
Nước tự nhiên và nước mưa có hoà tan khí CO2.
b. Tính chất hoá học
- H2CO3 là một axit yếu, dd H2CO3 làm quỳ tím chuyển thành mà nhạt.
- H2CO3 là một axít không bền bị phân huỷ thành CO2 và H2O.
1.2. Muối cacbonat
a. Phân loại: 2 loại
Cacbonat trung hoà gọi là muối cacbonat không còn nguyên tố H trong thành phần gốc axit.
Ví dụ: CaCO3, Na2CO3...
- Cacbonat axit được gọi là muối hyđrocacbonat có nguyên tố H trong thành phần gốc axit
Ví dụ: Ca(HCO3)2, NaHCO3...
b. Tính chất
- Tính tan
- Đa số muối cacbonat không tan trong nước trừ một số muối cacbonat của kim loại kiềm như Na2CO3, K2CO3...
- Hầu hết muối hyđrocacbonat tan trong nước như: Ca(HCO3)2; NaHCO3
- Tính chất hóa học
- Tác dụng với axit:
NaHCO3 + HCl → NaCl + CO2 + H2O
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Muối cacbonat tác dung với dd axit mạnh hơn axit cacbonic tạo thành muối mới và giải phóng khí CO2
- Tác dụng với dd bazơ:
2K2CO3 + Ca(OH)2 → CaCO3 +2 KOH
Kết luận: Một số dd muối cacbonat phản ứng với dd bazơ tạo thành muối cacbonat không tan và bazơ mới.
Chú ý: Muối hiđrocacbonat tác dụng với kiềm tạo thành muối trung hoà và nước
NaHCO3 + NaOH → Na2CO3 + H2O
- Tác dụng với dd muối:
Phương trình hóa học: Na2CO3 + CaCl2 → CaCO3 + 2NaCl
Hiện tượng: Có vẩn đục hoặc kết tủa trắng xuất hiện
Kết luận: Dung dịch muối cacbonat có thể tác dụng với 1 số dung dịch muối khác tạo thành 2 muối mới.
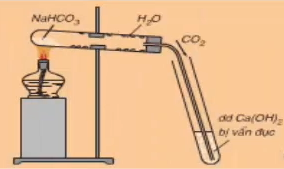
- Muối cacbonat dễ bị nhiệt phân huỷ:
Nhiều muối cacbonat (trừ cacbonat trung hoà của kim loại kiềm) dễ bị nhiệt phân huỷ giải phóng khí CO2
CaCO3 .PNG)
2NaHCO3 .PNG)
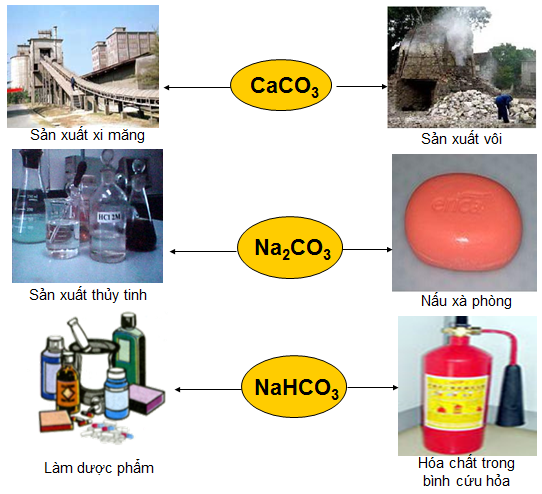
c. Ứng dụng
CaCO3 để sản xuất vôi, ximăng, Na2CO3 để nấu xà phòng, thuỷ tinh, NaHCO3 được dùng làm dược phẩm, hoá chất trong bình cứu hoả.
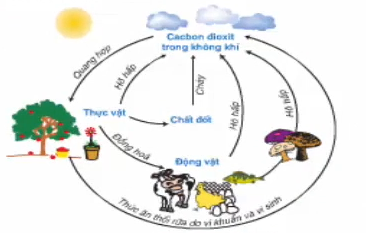
1.3. Chu trình của cacbon trong tự nhiên
Trong tự nhiên luôn có sự chuyển hoá cacbon từ dạng này sang dạng khác. Sự chuyển hoá này diễn ra thường xuyên, liên tục và tạo thành chu trình khép kín.
2. Bài tập minh họa
2.1. Dạng 1: Phương trình hóa học
Hãy cho biết trong các cặp chất sau đây, cặp nào có thể tác dụng với nhau.
a) H2SO4 và KHCO3
b) K2CO3 và NaCl
c) MgCO3 và HCl
d) CaCl2 và Na2CO3
e) Ba(OH)2 và K2CO3
Giải thích và viết các phương trình hóa học.
Hướng dẫn giải
Điều kiện của phản ứng trao đổi trong dung dịch chỉ xảy ra nếu sản phẩm có chất kết tủa (không tan) hoặc có chất khí tạo thành.
- Những cặp chất tác dụng với nhau:
a) H2SO4 + 2KHCO3 → K2SO4 + 2CO2↑+ 2H2O
c) MgCO3 + 2HCl → MgCl2 + CO2↑ + H2O
d) CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
e) Ba(OH)2 + K2CO3 → BaCO3↓ + 2KOH
- Cặp chất không tác dụng với nhau: b) K2CO3 và NaCl vì không có kết tủa hay chất khí nào tạo thành.
2.2. Dạng 2: Tính chất muối cacbonat
Nung nóng m gam hỗn hợp CaCO3 và MgCO3 đến phản ứng hoàn toàn, sau phản ứng thu được 2,72 gam hỗn hợp 2 oxit và 1344 ml khí CO2 (ở đktc). Hãy tính giá trị của m.
Hướng dẫn giải
Phương trình hóa học của phản ứng:
CaCO3 \(\xrightarrow{{{t^o}}}\) CaO + CO2
MgCO3 \(\xrightarrow{{{t^o}}}\) MgO + CO2
nCaCO3 = x; nMgCO3 = y
nCO2 = 1344 / 22400 = 0,06 mol
Ta có hệ phương trình
56x + 40y = 2,72
x + y = 0,06
Giải ra, ta có: x = 0,02 (mol); y = 0,04 (mol)
m = mCaCO3 + mMgCO3 = 0,02.100 + 0,04.84 = 5,36g
Vậy khối lượng của hỗn hợp là 5,36g.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Hãy viết phương trình hoá học của các phản ứng sau :
(1) 2C + ... → 2CO
(2) Fe2O3 + ... → 2Fe + CO2
(3) CO2 + ... → CaCO3 + H2O
Câu 2: Có hỗn hợp bột CaCO3 và CaSO4. Nêu cách để xác định thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp. Viết các phương trình hoá học, nếu có.
Câu 3: Cho 35 gam hỗn hợp X gồm Na2CO3 và K2CO3. Thêm từ từ , khuấy đều 0,8 lit HCl 0,5 M vào dung dịch X trên thấy có 2,24 lit khí CO2 thoát ra ở đktc và dung dịch Y. Thêm Ca(OH)2 vào dung dịch Y được kết tủa A. Tính khối lượng mỗi chất trong X và khối lượng kết tủa A ?
Câu 4: Cho 10,5 gam hỗn hợp X gồm Na2CO3 và K2CO3 tác dụng với HCl dư thì thu được 2,016 lit CO2 ở đktc.
a, Tính % khối lượng X?
b, Lấy 21 gam hỗn hợp Na2CO3 và K2CO3 với thành phần % như trên tác dụng với dung dịch HCl vừa đủ (không có khí CO2 bay ra). Tính thể tích dung dịch HCl 2M cần dùng?
c, Nếu thêm từ từ 0,12 lit dung dịch HCl 2M vào dung dịch chứa 21 gam hỗn hợp X trên. Tính thể tích CO2 thoát ra ở đktc?
3.2. Bài tập trắc nghiệm
Câu 1: Trong các muối sau, muối nào là muối hidrocacbonat?
A. K2CO3
B. MgCO3
C. Ba(HCO3)2
D. NaHSO3
Câu 2: Hấp thụ hoàn toàn 2,24 lít (đktc) CO2 vào 100ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít. Sau khi các phản ứng xảy ra hoàn toàn được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 dư được 11,82 gam kết tủa. Giá trị x là
A. 1,0 B. 1,4 C. 1,2 D. 1,6
Câu 3: Khi điện phân muối cacbonat, khí sinh ra là
A. SO3
B. CO2
C. O2
D. SO2
4. Kết luận
Sau bài học cần nắm:
- H2CO3 là axit rất yếu, không bền
- Muối cacbonat có những tính chất của muối như tác dụng với axit, với dd muối, với dd kiềm.
- Muối cacbonat dễ bị phân huỷ ở nhiệt độ cao và giải phóng khí CO2.
- Muối cacbonat có ứng dụng trong sản xuất và đời sống.
- Chu trình của cacbon trong tự nhiên và vấn để bảo vệ môi trường.
Tham khảo thêm
- doc Hoá học 9 Bài 25: Tính chất của phi kim
- doc Hóa học 9 Bài 26: Clo
- doc Hóa học 9 Bài 27: Cacbon
- doc Hoá học 9 Bài 28: Các oxit của cacbon
- doc Hoá học 9 Bài 30: Silic và công nghiệp silicat
- doc Hoá học 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- doc Hoá học 9 Bài 32: Luyện tập chương 3
- doc Hoá học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng
