Hóa học 9 Bài 22: Luyện tập chương 2 Kim loại
Nội dung bài Luyện tập kim loại ôn tập lại phần Dãy hoạt động hoá học của kim loại; Tính chất hoá học của kim loại nói chung; Tính chất giống và khác nhau giữa kim loại nhôm ,sắt (trong các chất nhôm chỉ có hoá trị III, sắt có hoá trị II, III. Nhôm phản ứng với dd kiềm tạo thành muối và giải phóng khí H2); Thành phần tính chất và sản xuất gang, thép; Sản xuất nhôm bằng cách điện phân hỗn hợp nóng chảy của nhôm oxít và criolít.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Tính chất hóa học của kim loại
Dãy hoạt động hóa học của kim loại: K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au.
Tính chất hóa học của kim loại:
Tác dụng với phi kim: 3Fe + 2O2 .PNG)
Tác dụng với nước: 2Na + 2H2O → 2NaOH + H2
Tác dụng với dung dịch axit: Fe + 2HCl → FeCl2 + H2
Tác dụng với dung dịch muối: 2Al + 3Cu(NO3)2 → 2Al(NO3)3 +3Cu
1.2. Tính chất hóa học của kim loại Nhôm và Sắt
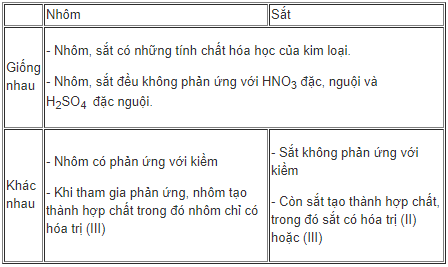
1.3. Hợp kim của Sắt
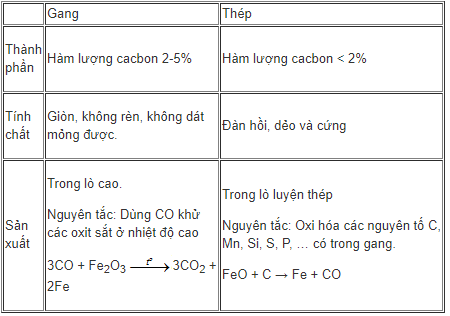
1.4. Ăn mòn kim loại và bảo vệ kim loại khỏi ăn mòn
Sự phá hủy kim loại, hợp kim do tác dụng của hóa học tron môi trường được gọi là sự ăn mòn kim loại.
Sự ăn mòn kim loại không xảy ra hoặc xảy ra nhanh hay chậm phụ thuộc vào thành phần của môi trường mà nó tiếp xúc.
Nhiệt độ cao sẽ làm cho sự ăn mòn kim loại xảy ra nhanh hơn
Để bảo vệ các đồ vật bằng kim loại khỏi bị ăn mòn:
- Ngăn không cho kim loại tác dụng với môi trường.
- Chế tạo hợp kim ít bị ăn mòn.
2. Bài tập minh họa
2.1. Dạng 1: Tính chất của kim loại
Câu 1: Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M.Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y.Giá trị của m là gì?
Hướng dẫn giải
\(\begin{array}{l} Fe{\rm{ }} + CuS{O_4} \to FeS{O_4} + C{u_ \downarrow }{\rm{ }}\\ {\rm{0,01}} \leftarrow {\rm{0,01}} \to {\rm{ 0,01}} \end{array}\)
mchất rắn = mCu + m Fe dư = 0,01.64 + (0,04-0,01).56 = 2,32 (gam)
Câu 2: Cho 6,5 gam bột Zn vào dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được m gam chất rắn. Giá trị của m là gì?
Hướng dẫn giải
Phương trình phản ứng:
Zn + CuSO4 → ZnSO4 + Cu
nZn = 0,1 (mol) ⇒ nCu = 0,1 (mol) ⇒ m = 6,4 (gam)
2.2. Dạng 2: Xác định kim loại
Để hoà tan 1,95 gam kim loại X cần dùng V ml dung dịch HCl và thu được 0,672 lít khí H2 (ở đktc). Mặt khác nếu hoà tan 1,6 gam oxit của kim loại Y cũng cần dùng V ml dung dịch HCl ở trên. Xác định hai kim loại X và Y.
Hướng dẫn giải
Thể tích dung dịch HCl dùng cho cả 2 phản ứng bằng nhau, nên có cùng số mol. Kí hiệu X, Y là khối lượng mol nguyên tử của 2 kim loại.
Phương trình hoá học của phản ứng :
2X + 2nHCl → 2XCln + nH2 ↑
nH2 = 0,672 /22,4 = 0,03 mol
Theo đề bài: (0,06/n) . X = 1,95 → X = 32,5n
Kẻ bảng
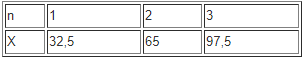
Y2Om + mHCl → YClm + mH2OVậy X là Zn
Theo đề bài, ta có:
(2Y + 16m) = 1,6 → Y = 56/3.m
Kẻ bảng

Vậy Y là Fe.
2.3. Dạng 3: Bài toán luyện gang thép
Người ta dùng 200 tấn quặng hematit hàm lượng Fe2O3 là 30% để luyện gang. Loại gang này chứa 95% Fe. Tính lượng gang thu được, biết hiệu suất của quá trình sản xuất là 96%.
Hướng dẫn giải
Khối lượng Fe2O3 trong quặng: 200 x 30/100 = 60 tấn
Khối lượng Fe2O3 tham gia phản ứng: 60x96/100 = 57,6 tấn
Phương trình của phản ứng luyện gang:
Fe2O3 + 3CO → 2Fe + 3CO2
mFe = x gam
x = 57,6x112/160 = 40,32 tấn
Lượng sắt này hoà tan một số phụ gia (C, Si, P, S...) tạo ra gang.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch CuSO4. Sau khi kết thúc các phản ứng, lọc bỏ phần dung dịch thu được m gam bột rắn. Xác định thành phần phần trăm theo khối lượng của Zn trong hỗn hợp bột ban đầu.
Câu 2: Hỗn hợp X gồm Al2O3 và Fe2O3. Dẫn khí CO qua 21,1 gam X và nung nóng thu được hỗn hợp Y gồm 5 chất rắn và hỗn hợp khí Z. Dẫn Z qua dung dịch Ca(OH)2 dư thấy có 15 gam kết tủa. Y tác dụng vừa đủ với 1 lít dung dịch H2SO4 0,35M thu được dung dịch T và có 1,12 lít khí thoát ra (đktc). Tính % theo khối lượng của Al2O3 trong hỗn hợp X.
Câu 3: Cho 0,83 g hỗn hợp gồm nhôm và sắt tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng thu được 0,56 lít khí ở đktc.
a) Viết các phương trình hóa học.
b) Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
Câu 4: Người ta dùng quặng boxit để sản xuất Al. Hàm lượng Al2O3 trong quặng là 40%. Để có được 4 tấn nhôm nguyên chất cần bao nhiêu tấn quặng ? Biết rằng hiệu suất của quá trình sản xuất là 90%.
3.2. Bài tập trắc nghiệm
Câu 1: Một bạn học sinh đã đổ nhầm dung dịch sắt (II) sunfat vào lọ chứa sẵn dung dịch kẽm sunfat. Để thu được dung dịch chứa duy nhất muối kẽm sunfat, theo em dùng kim loại nào?
A. Đồng
B. Sắt
C. Kẽm
D. Nhôm
Câu 2: Dãy các kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học tăng dần?
A. K, Mg, Cu, Al, Zn, Fe
B. Fe, Cu, K, Al, Zn
C. Cu, Fe, Zn, Al, Mg, K
D. Zn, K, Mg, Cu, Al, Fe
Câu 3: Con dao bằng thép không bị gỉ nếu:
A. Sau khi dùng, rửa sạch, lau khô.
B. Cắt chanh rồi không rửa
C. Ngâm trong nước muối một thời gian
D. Ngâm trong nước tự nhiên hoặc nước máy lâu ngày
Câu 4: Cho các kim loại Fe, Cu, Ag, Al, Mg. Trong các kết luận sau đây, kết luận nào sai?
A. Kim loại tác dung với dung dịch HCl, H2SO4 loãng: Cu, Ag
B. Kim loại tác dụng với dung dịch NaOH: Al
C. Kim loại không tác dụng với H2SO4 đặc nguội: Al, Fe
D. Kim loại không tan trong nước ở nhiệt độ thường: Tất cả các kim loại trên
4. Kết luận
Sau bài học cần nắm:
- Dãy hoạt động hoá học của kim loại; Tính chất hoá học của kim loại nói chung
- Tính chất giống và khác nhau giữa kim loại nhôm, sắt (trong các chất nhôm chỉ có hoá trị III, sắt có hoá trị II, III.
- Nhôm phản ứng với dd kiềm tạo thành muối và giải phóng khí H2)
- Thành phần tính chất và sản xuất gang, thép; Sản xuất nhôm bằng cách điện phân hỗn hợp nóng chảy của nhôm oxít và criolít.
Tham khảo thêm
- docx Hóa học 9 Bài 15: Tính chất vật lí của kim loại
- docx Hóa học 9 Bài 16: Tính chất hóa học của kim loại
- doc Hóa học Bài 17: Dãy hoạt động hóa học của kim loại
- docx Hóa học 9 Bài 18: Nhôm
- doc Hóa học 9 Bài 19: Sắt
- doc Hóa học 9 Bài 20: Hợp kim sắt: Gang, thép
- doc Hóa học 9 Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- doc Hoá học 9 Bài 23: Thực hành: Tính chất hóa học của nhôm và sắt
- doc Hóa học 9 Bài 24: Ôn tập học kì 1
