Hoá học 9 Bài 1: Tính chất hóa học của oxit và Khái quát về sự phân loại oxit
Nội dung bài học đi sâu tìm hiểu tính chất hóa học của oxit và giúp học sinh nắm bắt được cơ sở phân loại oxit.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Tính chất hóa học của oxit
a. Tính chất của oxit bazơ
- Tác dụng được với nước:
Một số oxit bazơ tác dụng với nước ở nhiệt độ thường là : Na2O; CaO; K2O; BaO, …tạo ra bazơ tan (kiềm) tương ứng là: NaOH, Ca(OH)2 , KOH, Ba(OH)2,…
Ví dụ: CaO + H2O → Ca(OH)2
- Tác dụng với axit:
Oxit bazơ tác dụng với axit tạo thành muối và nước.
Oxit bazơ + axit → muối + nước
Ví dụ: CuO + 2HCl → CuCl2 + H2O
- Tác dụng với oxit axit:
Một số oxit bazơ (CaO, BaO, Na2O, K2O,…) tác dụng với oxit axit tạo thành muối.
Oxit bazơ + oxit axit → muối
Ví dụ:
Na2O + CO2 → Na2CO3
CaO + CO2 CaCO3
b. Tính chất của oxit axit
Oxit axit ngoài cách gọi tên như trên còn có cách gọi khác là: anhiđric của axit tương ứng.
Ví dụ: SO2: Anhiđric sunfurơ (axit tương ứng là H2SO3: axit sunfurơ)
- Tác dụng với nước:
Nhiều oxit axit tác dụng với nước tạo thành dung dịch axit.
Một số oxit axit tác dụng với nước ở điều kiện thường như: P2O5, SO2, SO3,NO2, N2O5, CO2 , CrO3… tạo ra axit tương ứng như: H3PO4, H2SO3, H2SO4, HNO3, H2CO3, H2Cr2O7,...
Phương trình phản ứng:
2NO2 + H2O + 1/2O2 → 2HNO3
CO2 + H2O → H2CO3
- Tác dụng với dung dịch bazơ:
Oxit axit tác dụng với dung dịch bazơ tạo thành muối và nước.
Ví dụ: CO2 + Ca(OH)2 → CaCO3 (kết tủa trắng) + H2O
- Tác dụng với oxit bazơ:
Oxit axit tác dụng với một số oxit bazơ (CaO, BaO, Na2O, K2O,…) tạo thành muối.
1.2. Khái quát về sự phân loại oxit
Các oxit được chia thành 4 loại:
- Oxit bazơ: Là những oxit khi tác dụng với dung dịch axit tạo thành muối và nước.
Ví dụ: Na2O, CuO, BaO, FeO ….
- Oxit axit: Là những oxit khi tác dụng với dung dịch bazơ tạo thành muối và nước.
Ví dụ: SO2, SO3, CO2, P2O5 …
- Oxit lưỡng tính: Là những oxit khi tác dụng với dung dịch bazơ, và khi tác dụng với dung dịch axit tạo thành muối và nước.
Ví dụ: Al2O3, ZnO, …
- Oxit trung tính: Còn được gọi là oxit không tạo muối, là những oxit không tác dụng với axit, bazơ, muối.
Ví dụ: CO, NO…
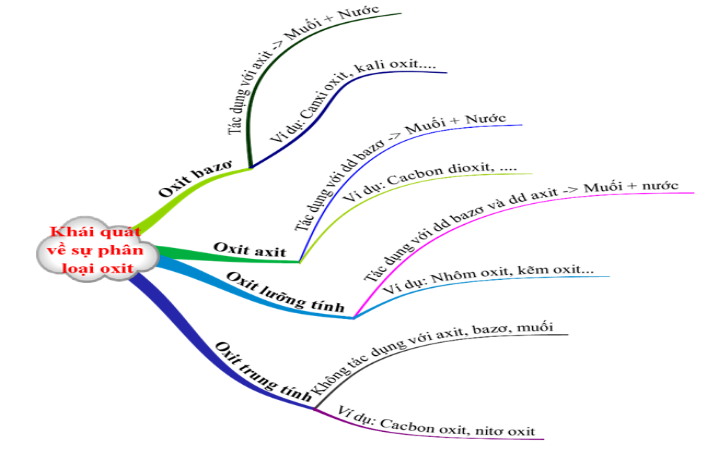
Hình 1: Khái quát về sự phân loại oxit
2. Bài tập minh họa
2.1. Dạng 1: Tính chất chất hóa học của oxit
Câu 1: Cho các chất khí sau đây:
Cacbon đioxit, hiđro, oxi, lưu huỳnh đioxit, nitơ. Chọn chất phù hợp với mô tả.
a) Nặng hơn không khí
b) Nhẹ hơn không khí
c) Cháy được trong không khí
d) Tác dụng được với nước tạo thành dung dịch làm quỳ hóa đỏ
e) Làm đục nước vôi trong
f) Đổi màu quỳ ẩm từ tím sang đỏ
Hướng dẫn giải
Cacbon đioxit (CO2), hiđro (H2), oxi (O2), lưu huỳnh đioxit (SO2), nitơ (N2)
a) Nặng hơn không khí là khí CO2 (44 > 29)
b) Nhẹ hơn không khí là H2, N2
c) Cháy được trong không khí là H2
d) Tác dụng được với nước tạo thành dung dịch làm quỳ hóa đỏ là SO2
e) Làm đục nước vôi trong là khí CO2
f) Đổi màu quỳ ẩm từ tím sang đỏ là khí SO2
Câu 2: Cho các chất sau: Đồng(II) oxit, hiđro, cacbon monooxit, lưu huỳnh trioxit, điphotpho pentaoxit, nước. Chọn chất thích hợp điền vào dấu ba chấm.
1. ...+ H2O → H2SO4
2. H2O+... → H3PO4
3. ...+ HCl → CuCl2 +H2O
4. ...+ H2SO4 → CuSO4 +...
Hướng dẫn giải
1. SO3 + H2O → H2SO4
2. 3H2O + P2O5 → 2H3PO4
3. Cu(OH)2 + 2HCl → CuCl2 + 2H2O
4. CuO + H2SO4 → CuSO4 + H2O
2.2. Dạng 2: Xác định khối lượng của oxit trong hỗn hợp
Hòa tan 4,88 gam hỗn hợp A gồm MgO và FeO trong 200ml dung dịch H2SO4 0,45M (loãng) thì phản ứng vừa đủ, thu được dung dịch B.Tính khối lượng mỗi oxit có trong hỗn hợp A.
Hướng dẫn giải
Vì phản ứng xảy ra vừa đủ nên hỗn hợp oxit kim loại và axit đều hết
Gọi số mol của MgO và FeO lần lượt là x và y
Phương trình phản ứng:
MgO + H2SO4 → MgSO4 + H2O
x → x
FeO+ H2SO4 → FeSO4 + H2O
y → y
Từ dữ kiện của bài toán ta có hệ phương trình:
\(\left\{ {\begin{array}{*{20}{l}} {40x + 72y = 4,88} \\ {x + y = 0,45.0,2 = 0,09} \end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{l}} {x = 0,05(mol)} \\ {y = 0,04(mol)} \end{array}} \right.\)
Khối lượng của MgO trong hỗn hợp là: mMgO = 0,05 . 40 = 2 (gam).
Khối lượng của FeO trong hỗn hợp là : mFeO = 4,88 - 2 = 2,88 (gam).
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Cho những oxit sau: CO2, SO2, Na2O, CaO, CuO. Hãy chọn một trong những chất đã cho tác dụng được với:
a) nước để tạo thành axit.
b) nước để tạo thành dung dịch bazơ.
c) dung dịch axit để tạo thành muối và nước.
d) dung dịch bazơ để tạo thành muối và nước.
Viết các phương trình phản ứng hóa học trên.
Câu 2: Cho 1,6g đồng (II) oxit tác dụng với 100g dung dịch axit sunfuric có nồng độ 20%.
a) Viết phương trình phản ứng hóa học.
b) Tính nồng độ phần trăm các chất có trong dung dịch sau khi phản ứng kết thúc.
3.2. Bài tập trắc nghiệm
Câu 1: Oxit là:
A. Hỗn hợp của nguyên tố oxi với một nguyên tố hoá học khác.
B. Hợp chất của nguyên tố phi kim với một nguyên tố hoá học khác.
C. Hợp chất của oxi với một nguyên tố hoá học khác.
D. Hợp chất của nguyên tố kim loại với một nguyên tố hoá học khác.
Câu 2: Oxit lưỡng tính là:
A. Những oxit tác dụng với dung dịch axit tạo thành muối và nước.
B. Những oxit tác dụng với dung dịch bazơ và tác dụng với dung dịch axit tạo thành muối và nước.
C. Những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
D. Những oxit chỉ tác dụng được với muối.
Câu 3: Oxit khi tan trong nước làm giấy quỳ chuyển thành màu đỏ là
A. MgO
B. P2O5
C. K2O
D. CaO
Câu 4: Có 1 ống nghiệm chứa nước và dung dịch phenolphtalein, cho oxit nào vào ống nghiệm trên thì làm cho phenolphtalein chuyển sang màu hồng?
A. CaO
B. CO2
C. CO
D. NO
Câu 5: Những dãy chất nào sau đây đều là oxit axit?
A. CO2, SO3, Na2O,NO2
B. CO2, SO2, H2O, P2O5
C. SO2, P2O5, CO2, N2O5
D. H2O, CaO, FeO, CuO
4. Kết luận
Sau bài học, cần nắm vững các nội dung sau:
- Tính chất hóa học của oxit axit và oxit bazơ.
- Cách phân loại các loại oxit.
- Vận dụng vào các bài tập liên quan.
Tham khảo thêm
- docx Hóa học 9 Bài 2: Một số oxit quan trọng
- docx Hóa học 9 Bài 3: Tính chất hóa học của axit
- docx Hóa học 9 Bài 4: Một số axit quan trọng
- docx Hóa học 9 Bài 5: Luyện tập tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 6: Thực hành: Tính chất hóa học của oxit và axit
- docx Hóa học 9 Bài 7: Tính chất hóa học của bazơ
- docx Hóa học 9 Bài 8: Một số bazơ quan trọng
- docx Hóa học 9 Bài 9: Tính chất hóa học của muối
- doc Hóa học 9 Bài 10: Một số muối quan trọng
- docx Hóa học 9 Bài 11: Phân bón hóa học
- docx Hóa học 9 Bài 12: Mối quan hẹ giữa các loại hợp chất vô cơ
- docx Hóa học 9 Bài 13: Luyện tập chương 1 Các loại hợp chất vô cơ
- docx Hóa học 9 Bài 14: Thực hành: Tính chất hóa học của bazơ và muối
