Hóa học 9 Bài 18: Nhôm
Các em đã biết tính chất của kim loại. Hãy tìm hiểu tính chất của một kim loại cụ thể có nhiều ứng dụng trong đời sống, sản xuất, đó là nhôm. Nhôm có tính chất vật lí và hoá học nào? Các em hãy dự đoán và nêu những tính chất em đã biết về nhôm
Mục lục nội dung

Hóa học 9 Bài 18: Nhôm
1. Tóm tắt lý thuyết
1.1. Tính chất vật lí
Màu trắng bạc, có ánh kim, nhẹ (D= 2,7g/cm3), dẫn điện, dẫn nhiệt tốt, nóng chảy ở 6600C,dẻo.

Tính chất vật lí của nhôm
1.2. Tính chất hoá học
a. Nhôm có những tính chất hoá học của kim loại không?
- Phản ứng của nhôm với phi kim
+ Phản ứng của nhôm với oxi
4Al + 3O2 → 2Al2O3
trắng không màu trắng
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp oxit nhôm mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
+ Phản ứng của nhôm với phi kim khác
2Al + 3Cl2 → 2AlCl3
trắng vàng lục trắng
- Phản ứng của nhôm với dung dịch axit
2Al + 6HCl → 2AlCl3 + 3H2
Lưu ý: Nhôm không tác dụng với HNO3 đặc nguội và H2SO4 đặc nguội
- Phản ứng của nhôm với dung dịch muối
2Al + 3CuCl2 → 2AlCl3 + 3Cu
Nhôm phản ứng được với nhiều dung dịch muối của những kim loại hoạt động hoá học yếu hơn tạo ra muối nhôm và kim loại mới
Kết luận:Nhôm có những tính chất hoá học của kim loại.
b. Nhôm có tính chất hóa học nào khác?
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
1.3. Ứng dụng của nhôm
- Chế tạo đồ dùng gia đình, dây dẫn điện, vật liệu xây dựng
- Chế tạo hợp kim dùng trong công nghiệp chế tạo máy bay, ô tô

Ứng dụng của nhôm
1.4. Sản xuất nhôm
- Nguyên liệu để sản suất nhôm là quặng boxit có thành phần chủ yếu là Al2O3.
- Phương pháp: Điện phân hỗn hợp nóng chảy của nhôm oxit và criolit
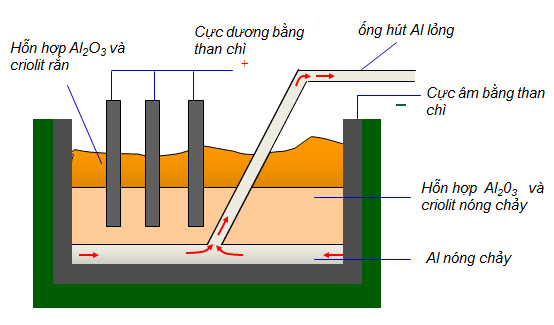
Sơ đồ bể điện phân nhôm oxit nóng chảy
1.5. Tổng kết
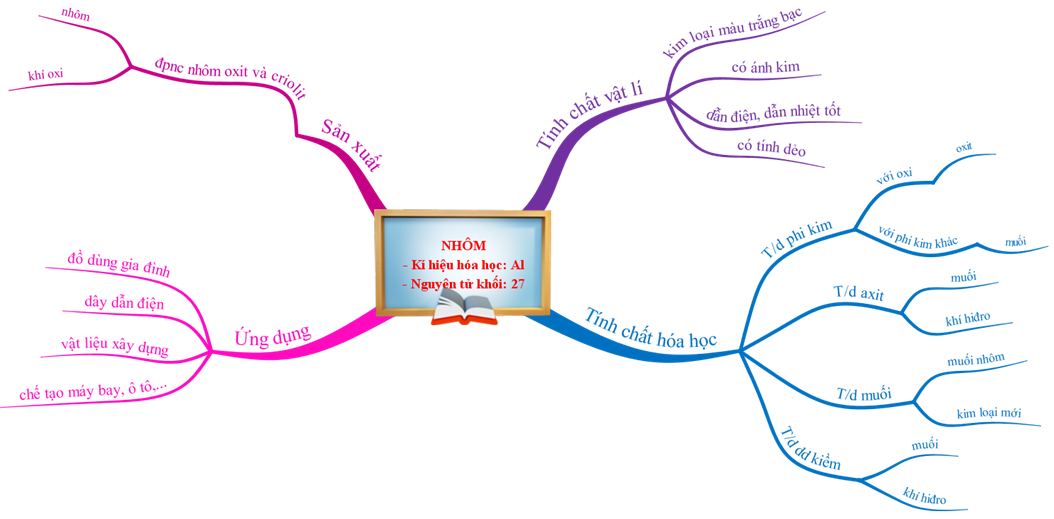
Sơ đồ tư duy bài nhôm
2. Bài tập minh họa
2.1. Dạng 1: Viết phương trình hóa học tính chất của nhôm
Viết các phương trình hóa học thực hiện những chuyển đổi hóa học sau:
Al → Al2O3 → AlCl3 → Al(OH)3 → Al2O3
Al → Al2S3
Hướng dẫn giải
Phương trình hóa học của dãy chuyển hóa trên:
(1) 4Al + 3O2 2Al2O3
(2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(3) AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
(4) 2Al(OH)3 Al2O3 + 3H2O
(5) 2Al + 3S Al2S3
2.2. Dạng 2: Bài tập nhôm tác dụng với axit
Hoà tan 4,5 gam hợp kim nhôm - magie trong dung dịch H2SO4 loãng, dư, thấy có 5,04 lít khí hiđro bay ra (đktc).
a) Viết phương trình hoá học
b) Tính thành phần phần trăm khối lượng của các kim loại trong hợp kim
Hướng dẫn giải
a) Phương trình hóa học:
Mg + H2SO4 → MgSO4 + H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
b) nH2 = 5,04 / 22,4 = 0,225 mol
Gọi nMg = x; nAl = y
Ta có hệ phương trình
24x + 27y = 4,5 (I) và x + 3y/2 = 0,225 (II)
Giải phương trình (I) và (II), ta tìm được x và y.
x = 0,075; y = 0,1
mMg = 1,8 g; mAl = 2,7 g
%mMg = 40%; %mAl = 60%
Vậy phần phần trăm khối lượng của các kim loại trong hợp kim lần lượt là 40% Mg và 60% Al.
2.3. Dạng 3: Nhôm tác dụng với oxit kim loại
Trộn 5,4 g Al với 4,8 g Fe2O3 rồi nung nóng để thực hiện phản ứng nhiệt nhôm. Sau phản ứng ta thu được m (gam) hỗn hợp chất rắn. Xác định giá trị m.
Hướng dẫn giải
Phương trình phản ứng:
2Al + Fe2O3 → Al2O3 + 2Fe
Nhận thấy, khối lượng trước phản ứng luôn bằng khối lượng các chất sau phản ứng. Các chất sau phản ứng là Al2O3 và Fe đều là chất rắn nên ta có:
m hỗn hợp sau phản ứng = mAl+mFe2O3=5,4+4,8=10,2(g).
2.4. Dạng 4: Nhôm tác dụng với dung dịch kiềm
Cho 5,4 gam bột nhôm tác dụng với 100 ml dung dịch NaOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn thu được V lít khí hiđro (đktc). Giá trị của V là bao nhiêu?
Hướng dẫn giải
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,2 0,2
Sau phản ứng Al dư, NaOH hết
nkhí = 0,03 mol → V = 0,03.22,4 = 0,672 lít.
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Viết các phương trình hóa học thực hiện những chuyển đổi hóa học sau:
Al2O3 → Al → Al2(SO4)3 → AlCl3 → Al(OH)3 → Al2O3
Câu 2: Cho 5,4 gam Al vào 100 ml dung dịch H2SO4 0,5M.
a) Tính thể tích khí H2 sinh ra (đktc).
b) Tính nồng độ mol của các chất trong dung dịch sau phản ứng. Cho ràng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Câu 3: Nung nóng m gam hỗn hợp Al và Fe2O3 (trong môi trường không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau:
- Phần 1 tác dụng với dung dịch H2SO4 loãng (dư), sinh ra 3,08 lít khí H2 (ở đktc)
- Phần 2 tác dụng với dung dịch NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc)
Câu 4: Cho 15,6 gam hỗn hợp bột Al và Al2O3 tác dụng với một lượng dư dung dịch KOH. Khi phản ứng kết thúc, thu được 6,72 lít H2 (đktc). Xác định phần trăm theo khối lượng của Al trong hỗn hợp.
3.2. Bài tập trắc nghiệm
Câu 1: Kim loại tác dụng được với tất cả các chất : HCl , CuCl2, NaOH, O2
A. Mg
B. Ca
C. Al
D. Fe
Câu 2: Trong bột sắt có lẫn bột nhôm , để làm sạch bột sắt có thể đem ngâm trong dung dịch:
A. Dung dịch HCl
B. Dung dịch CuSO4
C. Dung dịch NaOH
D. Nước
Câu 3: Cặp chất phản ứng được với AlCl3 là:
A. Zn và HCl
B. Fe và AgNO3
C. Mg và
D. HCl và AgNO3
Câu 4: Oxi hóa hoàn toàn 8,1 gam nhôm cần vừa đủ V lít khí clo (đktc). Giá tri ̣của V là
A. 10,08.
B. 6,72.
C. 7,84.
D. 11,2.
Câu 5: Hòa tan 9,72g Al bằng dung dịch H2SO4 loãng thu được V lit khí H2 (dktc). Giá trị của V là :
A. 12,096
B. 4,032
C. 24,192
D. 8,064
4. Kết luận
Sau bài học cần nắm:
- Tính chất vật lí của nhôm: nhẹ, dẻo, dẫn điện, dẫn nhiệt tốt.
- Tính chất hoá học của nhôm: Nhôm có tính chất hoá học của kim loại nói chung. Ngoài ra nhôm còn có pứ với dd kiềm giải phóng khí H2, nhôm không phản ứng HNO3 đặc nguội và H2SO4 đặc nguội.
- Phương pháp sản xuất nhôm bằng cách điện phân nhôm oxit nóng chảy.
Tham khảo thêm
- docx Hóa học 9 Bài 15: Tính chất vật lí của kim loại
- docx Hóa học 9 Bài 16: Tính chất hóa học của kim loại
- doc Hóa học Bài 17: Dãy hoạt động hóa học của kim loại
- doc Hóa học 9 Bài 19: Sắt
- doc Hóa học 9 Bài 20: Hợp kim sắt: Gang, thép
- doc Hóa học 9 Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- doc Hóa học 9 Bài 22: Luyện tập chương 2 Kim loại
- doc Hoá học 9 Bài 23: Thực hành: Tính chất hóa học của nhôm và sắt
- doc Hóa học 9 Bài 24: Ôn tập học kì 1

