Hoá học 9 Bài 25: Tính chất của phi kim
Nội dung bài giảng Tính chất của phi kim tìm hiểu về một số tính chất vật lí của phi kim: Phi kim tồn tại ở 3 trạng thái rắn, lỏng, khí. Phần lớn các nguyên tố phi kim không dẫn điện, dẫn nhiệt, nhiệt độ nóng chảy thấp; Biết những tính chất hoá học chung của phi kim: Tác dụng với oxi, với kim loại và với hiđrô. Sơ lược về mức độ hoạt động hoá học mạnh yếu của 1 số phi kim.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Tính chất vật lí
- Phi kim có thể tồn tại ở trạng thái:Thể rắn I2, S, C..., thể lỏng Br2, thể khí O2, Cl2...
- Không dẫn điện, không dẫn nhiệt, và có nhiệt độ nóng chảy thấp
1.2. Tính chất hóa học
a. Tác dụng với kim loại
- Nhiều phi kim tác dụng với kim loại tạo thành muối
- Các em chú ý quan sát thao tác thí nghiệm, cũng như hiện tượng xảy ra như sau:
- Hiện tượng: Sắt cháy sáng trong khí clo, xuất hiện chất màu nâu đỏ
- Giải thích: Do xảy ra phản ứng 2Fe + 3Cl2
2FeCl3
- Ví dụ khác: Fe (trắng xám) + S (vàng)
FeS (đen)
- Chú ý: Khi phi kim là Oxi thì Kim loại + Oxi tạo Oxit
- Ví dụ như: 2Cu + O2
2CuO
b. Tác dụng với hiđro
Oxi tác dụng với khí tạo thành nước: 2H2 + O2 .PNG)
Clo tác dụng với khí hiđro
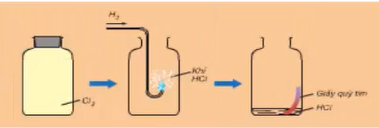
H2 + Cl2 .PNG)
Ngoài ra, nhiều phi kim khác như C, S, Br,... tác dụng với Hidro tạo hợp chất khí.
c. Tác dụng với Oxi
S (vàng) + O2 .PNG)
4P (đỏ) +5 O2 .PNG)
Nhiều phi kim tác dụng với oxi tạo thành oxít axít
d. Mức độ hoạt động của phi kim
Mức độ hoạt động hoá học mạnh hay yếu của phi kim được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro
Ví dụ:
F,Cl, O là những phi kim mạnh
S, P, C, Si là những phi kim yếu
2. Bài tập minh họa
2.1. Dạng 1: Phương trình hóa học của phi kim
Cho các chất sau: Cl2, S, Cu, Mg.
a. Chất nào tác dụng với khí oxi tạo thành oxit axit?
b. Chất nào tác dụng với khí oxi tạo thành oxit bazơ?
c. Chất nào tác dụng với kim loại đồng tạo thành muối?
Hướng dẫn giải
a. Chất nào tác dụng với khí oxi tạo thành oxit axit là Lưu huỳnh (S)
S + O2 .PNG)
b. Chất nào tác dụng với khí oxi tạo thành oxit bazơ là Đồng (Cu), Magie (Mg)
2Cu + O2 .PNG)
2Mg + O2 .PNG)
c. Chất nào tác dụng với kim loại đồng tạo thành muối là Clo, lưu huỳnh
Cu + Cl2 .PNG)
Cu + S .PNG)
2.2. Dạng 2: Bài toán định lượng
Câu 1: Để chuyển 11,2 gam Fe thành FeCl3 thì thể tích khí clo (ở đktc) cần dùng là
Hướng dẫn giải
Fe + 1,5Cl2 → FeCl3
\(\Rightarrow n_{Cl_2}=1,5n_{Fe}=0,3\ mol\)
⇒ V = 6,72 lít
Câu 2: Nung hỗn hợp gồm 5,6g sắt và 1,6g lưu huỳnh trong môi trường không có không khí thu được hỗn hợp chất rắn A. Cho dung dịch HCl 1M phản ứng vừa đủ với A thu được hỗn hợp khí B.
Viết các phương trình hóa học và tính thể tích dung dịch HCl 1M đã tham gia phản ứng.
Hướng dẫn giải
Phương trình phản ứng:
Fe + S → FeS (1)
Theo phương trình:
Nên hỗn hợp chất rắn A có Fe dư và FeS
Dựa vào phương trình phản ứng (2) và (3), ta có:
2.3. Dạng 3: Xác định tên phi kim
R là nguyên tố phi kim. Hợp chất của R với hiđro có công thức chung là RH: chứa 5,88% H. R là nguyên tố nào sau đây ?
A. Cacbon
B. Nitơ
C. Photpho
D. Lưu huỳnh
Hướng dẫn giải
Nguyên tử khối của R= 2.(100 - 5,88)/5,88 ≈ 32 (đvC)
Nguyên tố R là lưu huỳnh (S)
→ Đáp án D
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: Đốt bột 13g Zn trong không khí, sau khi kết thúc phản ứng, người ta cho vào hỗn hợp một lượng dư dung dịch HCl thì thấy có khí 3,36l
Câu 2: Một hỗn hợp gồm
Câu 3: X là nguyên tố phi kim có hoá trị III trong hợp chất với khí hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65%. Xác định nguyên tố X.
3.2. Bài tập trắc nghiệm
Câu 1: Nung 11,2g Fe và 26g Zn với một lượng lưu huỳnh có dư. Sản phẩm của phản ứng cho tan hoàn toàn trong axit HCl. Khí sinh ra được dẫn vào dd CuSO4. Thể tích dd CuSO4 10% (d = 1,1) cần phải lấy để hấp thụ hết khí sinh ra là (ml)
A. 500,6 B. 376,36 C. 872,72 D. 525,25 E. Kết quả khác
Câu 2: Dãy gồm các phi kim được sắp xếp theo thứ tự tính oxi hoá tăng dần từ trái sang phải là :
A. Flo, oxi, clo ; B. Clo, oxi, flo ;
C. Oxi, clo, flo ; D. Clo, flo, oxi
Câu 3: Phát biểu nào sau đây không đúng ?
A. Nhiều phi kim tác dụng với oxi thành oxit axit.
B. Phi kim phản ứng với hiđro tạo thành hợp chất khí.
C. Phi kim tác dụng với kim loại tạo thành muối.
D. Phi kim tác dụng với kim loại tạo thành muối hoặc oxit.
4. Kết luận
Sau bài học cần nắm:
- Phi kim có những tính chất vật lí nào?
- Phi kim có những tính chất hoá học nào?
- Vận dụng vào các bài tập có liên quan.
Tham khảo thêm
- doc Hóa học 9 Bài 26: Clo
- doc Hóa học 9 Bài 27: Cacbon
- doc Hoá học 9 Bài 28: Các oxit của cacbon
- doc Hoá học 9 Bài 29: Axit cacbonic và muối cacbonat
- doc Hoá học 9 Bài 30: Silic và công nghiệp silicat
- doc Hoá học 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- doc Hoá học 9 Bài 32: Luyện tập chương 3
- doc Hoá học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng
