Hoá học 9 Bài 32: Luyện tập chương 3
Nội dung bài giảng giúp học sinh hệ thống hoá lại các kiến thức trong chương như: tính chất của phi kim, muối cacbonat. Cấu tạo bảng tuần hoàn và sự biến đổi tuần hoàn tính chất của các nguyên tố trong chu kì, nhóm và ý nghĩa của bảng tuần hoàn.
Mục lục nội dung

1. Tóm tắt lý thuyết
1.1. Tính chất hóa học của phi kim
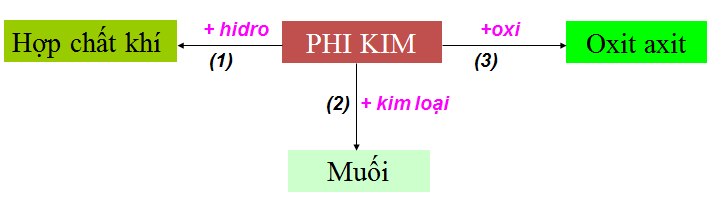
1.2. Tính chất hóa học của phi kim (cụ thể)
a. Tính chất hóa học của Clo
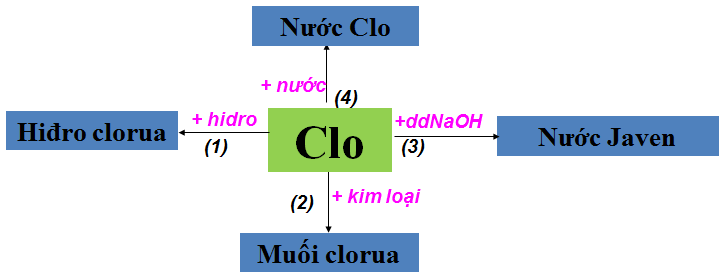
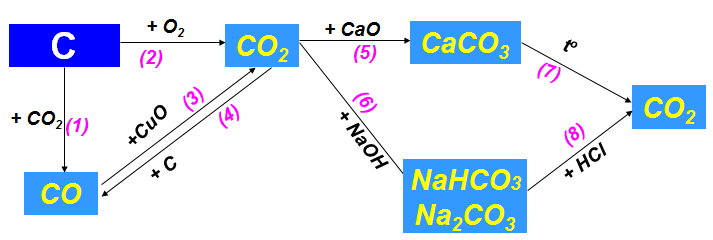
b. Tính chất hóa học của cacbon và hợp chất của cacbon
1.3. Bảng tuần hoàn các nguyên tố hóa học
a. Cấu tạo bảng tuần hoàn
- Ô nguyên tố cho biết:
- Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số e = vị trí.
- Ký hiệu hóa học.
- Tên nguyên tố.
- Nguyên tử khối.
-
Chu kì: Có 7 chu kì gồm chu kì nhỏ (1, 2, 3) và chu kì lớn (4, 5, 6, 7)
-
Nhóm: Có 8 nhóm
b. Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
- Trong một chu kỳ đi từ trái sang phải tính kim loại của các nguyên tố giảm dần, tính phi kim của các nguyên tố tăng dần.
- Trong một nhóm đi từ trên xuống tính kim loại của các nguyên tố tăng dần, tính phi kim của các nguyên tố giảm dần.
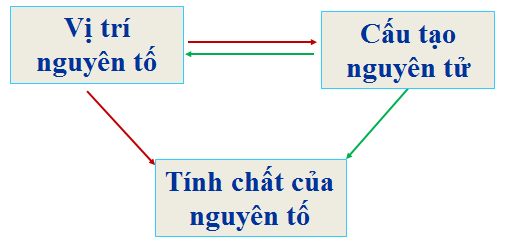
c. Ý nghĩa của bảng tuần hoàn
- Biết vị trí của nguyên tố → cấu tạo nguyên tử và tính chất của nguyên tố.
- Biết cấu tạo nguyên tử → vị trí và tính chất của nguyên tố.
2. Bài tập minh họa
2.1. Dạng 1: Xác định nguyên tố
Thể tích khí clo cần phản ứng với kim loại M bằng 1,5 lần lượng khí sinh ra khi cho cùng lượng kim loại đó tác dụng hoàn toàn với dung dịch axit HCl dư trong cùng điều kiện. Khối lượng muối clorua sinh ra trong phản ứng với clo gấp 1,2886 lần lượng sinh ra trong phản ứng với axit HCl. Xác định kim loại M
Hướng dẫn giải
Phương trình hóa học của phản ứng:
M + n/2HCl → MCln
M + mHCl → MClm + m/2H2
Theo đề bài, ta có:
\(\left\{ \begin{array}{l}
\frac{n}{2} = 1,5.\frac{m}{2}\\
n,m = 1,2,3
\end{array} \right. \to \left\{ \begin{array}{l}
n = 3\\
m = 2
\end{array} \right.\)
và M + 106,5 = 1,2886.(M+71)
Giải ra, ta có M = 52 (Cr)
Vậy kim loại M là crom.
2.2. Dạng 2: Tính chất muối cacbonat
Hoà tan 10 gam hỗn hợp 2 muối cacbonat của kịm loại hoá trị II và III bằng dung dịch HCl, ta thu được dung dịch X và 0,672 lít khí bay ra (ở đktc). Tính khối lượng muối thu được khi cô cạn dung dịch X.
Hướng dẫn giải
Áp dụng phương pháp tăng giảm khối lượng
Viết phương trình hoá học của XCO3 và Y2(CO3)3 với dung dịch HCl, ta nhận thấy khi chuyển từ muối cacbonat thành muối clorua thì cứ 1 mol CO2 bay ra thì khối lượng tăng : 71 - 60 = 11 (gam)
0,03 mol CO2 bay ra thì khối lượng tăng: 0,03 . 11 gam
Tổng khối lượng muối clorua tạo thành: 10 + (0,03 . 11)= 10,33 (gam)
2.3. Dạng 3: Tính chất của nguyên tố
Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng hệ thống tuần hoàn. Hãy cho biết:
- Cấu tạo nguyên tử của A.
- Tính chất hóa học đặc trưng của A.
- So sánh tính chất hóa học của A với các nguyên tố lân cận.
Hướng dẫn giải
- Số hiệu nguyên tử của A là 11 cho biết: Natri ở ô số 11, điện tích hạt nhân nguyên tử natri là 11+ , có 11 electron trong nguyên tử natri, ở chu kì 3, nhóm I.
- Tính chất hóa học đặc trưng của natri:
Nguyên tố natri là kim loại mạnh, trong phản ứng hóa học, natri là chất khử mạnh.
- Tác dụng với phi kim:
4Na + O2 → 2Na2O
2Na + Cl2 → 2NaCl
- Tác dụng với dung dịch axit:
2Na + 2HCl → 2NaCl + H2↑
- Tác dụng với nước:
2Na + 2H2O → 2NaOH + H2↑
- Tác dụng với dung dịch muối:
2Na + 2H2O → 2NaOH +H2↑
2NaOH + CuSO4 → Cu(OH)2↓ +Na2SO4
- So sánh tính chất hóa học của Na với các nguyên tố lân cận: Na có tính chất hóa học mạnh hơn Mg (nguyên tố đứng sau Na trong cùng chu kì) và mạnh hơn nguyên tố Li (nguyên tố đứng trên Na trong cùng một nhóm) nhưng yếu hơn nguyên tố K (nguyên tố đứng dưới Na trong cùng một nhóm).
3. Luyện tập
3.1. Bài tập tự luận
Câu 1: X, Y là hai nguyên tố halogen thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Hỗn hợp A chứa 2 muối X, Y với natri. Để kết tủa hoàn toàn 2,2 gam hỗn hợp A phải dùng 150 ml dung dịch AgNO3 0,2M. Xác định hai nguyên tố X và Y.
Câu 2: Hai nguyên tố X và Y ở hai chu kì kế tiếp nhau trong bảng tuần hoàn các nguyên tố hoá học và có tổng số điện tích hạt nhân là 16.
a) Xác định tên các nguyên tố X và Y
b) Cho biết vị trí của 2 nguyên tố trong bảng tuần hoàn.
Câu 3: Cho hỗn hợp 2 kim loại Fe và Cu tác dụng với khí clo dư thu được 59,5 gam hỗn hợp muối. Cũng lượng hỗn hợp trên cho tác dụng với lượng dư dung dịch HCl 10% thu được 25,4 gam một muối.
a) Tính phần trăm khối lượng mỗi muối trong hỗn hợp muối thu được.
b) Tính thể tích dung dịch HCl 10% (D = 1,0 g/ml) cần dùng.
3.2. Bài tập trắc nghiệm
Câu 1: Sản phẩm của phản ứng khi đốt cháy hoàn toàn lần lượt lưu huỳnh, hiđro, cacbon, photpho, trong khí oxi dư là:
A. SO2, H2O, CO2, P2O5
B. SO3, H2O, CO2, P2O5
C. SO2, H2O, CO, P2O5
D. SO3, H2O, CO, P2O5
Câu 2: Sục khí clo vào dung dịch KOH ở nhiệt độ thường, sản phẩm của phản ứng gồm:
A. KCl, H2O, K2O
B. KCl, KClO, H2O
C. KCl, KClO3, H2O
D. KClO, KClO3, H2O
Câu 3: Một nguyên tố X tạo được các hợp chất sau: XH3, X2O5. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X cùng nhóm với
A. agon
B. nitơ
C. oxi
D. flo
Câu 4: Trong luyện kim, người ta sử dụng cacbon và hoá chất nào để điều chế kim loại?
A. Một số oxit kim loại như PbO, ZnO, CuO, ...
B. Một số bazơ như NaOH, Ca(OH)2, Cu(OH)2, ...
C. Một số axit như HNO3; H2SO4; H3PO4, ....
D. Một số muối như NaCl, CaCl2, CuCl2, ...
4. Kết luận
Sau bài học cần nắm:
-
Tính chất hóa học của phi kim.
-
Bảng tuần hoàn các nguyên tố hóa học.
Tham khảo thêm
- doc Hoá học 9 Bài 25: Tính chất của phi kim
- doc Hóa học 9 Bài 26: Clo
- doc Hóa học 9 Bài 27: Cacbon
- doc Hoá học 9 Bài 28: Các oxit của cacbon
- doc Hoá học 9 Bài 29: Axit cacbonic và muối cacbonat
- doc Hoá học 9 Bài 30: Silic và công nghiệp silicat
- doc Hoá học 9 Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- doc Hoá học 9 Bài 33: Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng
