Giải bài tập SBT Hóa 10 Bài 12: Liên kết ion - Tinh thể ion
Lời giải chi tiết và chính xác cho 22 bài tập trang 30,31 SBT Hóa lớp 10 đã được eLib sưu tầm và tổng hợp dưới đây sẽ giúp các em học tập thật tốt chuyên đề Liên kết ion - Tinh thể ion. Mời các bạn tải về tham khảo chuẩn bị cho bài học sắp tới.
Mục lục nội dung
1. Giải bài 12.1 trang 29 SBT Hóa học 10
2. Giải bài 12.2 trang 29 SBT Hóa học 10
3. Giải bài 12.3 trang 29 SBT Hóa học 10
4. Giải bài 12.4 trang 29 SBT Hóa học 10
5. Giải bài 12.5 trang 29 SBT Hóa học 10
6. Giải bài 12.6 trang 30 SBT Hóa học 10
7. Giải bài 12.7 trang 30 SBT Hóa học 10
8. Giải bài 12.8 trang 30 SBT Hóa học 10
9. Giải bài 12.9 trang 30 SBT Hóa học 10
10. Giải bài 12.10 trang 30 SBT Hóa học 10
11. Giải bài 12.11 trang 30 SBT Hóa học 10
12. Giải bài 12.12 trang 30 SBT Hóa học 10
13. Giải bài 12.13 trang 30 SBT Hóa học 10
14. Giải bài 12.14 trang 31 SBT Hóa học 10
15. Giải bài 12.15 trang 31 SBT Hóa học 10
16. Giải bài 12.16 trang 31 SBT Hóa học 10
17. Giải bài 12.17 trang 31 SBT Hóa học 10
18. Giải bài 12.18 trang 31 SBT Hóa học 10
19. Giải bài 12.19 trang 31 SBT Hóa học 10
20. Giải bài 12.20 trang 31 SBT Hóa học 10

1. Giải bài 12.1 trang 29 SBT Hóa học 10
Các ion và nguyên tử 9F-, 10Ne, 11Na+ giống nhau về
A. số khối.
B. số electron.
C. số proton.
D. số nơtron
Phương pháp giải
Viết cấu hình e, xác định số p, số e, số n, số khối của từng ion và nguyên tử
Hướng dẫn giải
9F-: (Z = 9): 1s22s22p6 => Có 10e, 9p
10Ne: (Z = 10): 1s22s22p6 => Có 10e, 10p
11Na+ (Z = 11): 1s22s22p6 => Có 10e, 11p
→ Chọn B
2. Giải bài 12.2 trang 29 SBT Hóa học 10
Cấu hình electron nguyên tử X và Y lần lượt là 1s22s22p63s23p64s1 và 1s22s22p5 Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A. cho - nhận.
B. kim loại.
C. ion
D. cộng hoá trị.
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
X thuộc nhóm IA là kim loại điển hình
Y thuộc nhóm VIIA là phi kim điển hình
→ liên kết giữa X và Y là liên kết ion
→ Chọn C
3. Giải bài 12.3 trang 29 SBT Hóa học 10
X thuộc chu kì 3, nhóm IA, Y thuộc chu kì 3, nhóm VIIA. Công thức phân tử và bản chất liên kết của hợp chất giữa X và Y là
A. X2Y ; liên kết ion
B. XY ; liên kết ion.
C. XY2 ; liên kết cộng hoá trị.
D. X2Y2 ; liên kết cộng hoá trị.
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
X thuộc nhóm IA là kim loại điển hình, điện tích 1+
Y thuộc nhóm VIIA là phi kim điển hình, điện tích 1-
→ CT là XY, liên kết giữa X và Y là liên kết ion
→ Chọn B
4. Giải bài 12.4 trang 29 SBT Hóa học 10
Hợp chất trong phân tử có liên kết ion là
A. NH4Cl.
B. NH3.
C. HCl.
D. H2O.
Phương pháp giải
Xem lại lý thuyết liên kết ion
Hướng dẫn giải
Liên kết ion là lực hút tĩnh điện giữa 2 ion mang điện tích trái dấu
NH4Cl được tạo thành từ ion \(NH_4^ + \) và \(C{l^ - }\)
→ Chọn A
5. Giải bài 12.5 trang 29 SBT Hóa học 10
Khi phản ứng hoá học xảy ra giữa những nguyên tử có cấu hình electron ở trạng thái cơ bản là 1s22s1 và 1s22s22p5 thì liên kết này là
A. liên kết cộng hoá trị có cực .
B. liên kết cộng hoá trị không cực
C. liên kết ion
D. liên kết kim loại
Phương pháp giải
Xem lại lý thuyết liên kết ion
Hướng dẫn giải
1s22s1 thuộc nhóm IA là kim loại điển hình
1s22s22p5 thuộc nhóm VIIA là phi kim điển hình
→ liên kết giữa 2 nguyên tố trên là liên kết ion
→ Chọn C
6. Giải bài 12.6 trang 30 SBT Hóa học 10
Cấu hình electron nguyên tử A là [Ar]4s2 và nguyên tử B là [Ne]3s23p5.
Công thức hợp chất giữa A và B và bản chất liên kết trong hợp chất này là
A. AB2, ion.
B. AB, ion.
C. A2B , cộng hoá trị.
D.A2B3, kim loại.
Phương pháp giải
Xem lại lý thuyết liên kết ion
Hướng dẫn giải
A thuộc nhóm IIA là kim loại điển hình, điện tích 2+
B thuộc nhóm VIIA là phi kim điển hình, điện tích 1-
→ CT: AB2 liên kết giữa X và Y là liên kết ion
→ Chọn A
7. Giải bài 12.7 trang 30 SBT Hóa học 10
Dãy gồm các ion X+,Y− và nguyên tử M đều có cấu hình electron 1s22s22p6. X, Y và M là các nguyên tố
A. kali, clo và neon
B. natri, clo và neon
C. kali, canxin và nhôm
D. natri, flo và neon
Phương pháp giải
ion duơng hình thành do sự nhường e
ion âm hình thành do sự nhận e
Hướng dẫn giải
X+ : 1s22s22p6 → X: 1s22s22p63s1; Z = 11 → X: Na
Y−: 1s22s22p6 → Y: 1s22s22p5; ZY = 9 (F)
M: 1s22s22p6 → ZM = 10(Ne)
8. Giải bài 12.8 trang 30 SBT Hóa học 10
Điện tích của electron và điện tích của proton (tính ra culông, C) bằng bao nhiêu?
Hãy cho biết tên gọi và kí hiệu của các điện tích đó?
Phương pháp giải
Xem lại lý thuyết liên kết ion
Hướng dẫn giải
Điện tích của electron :qe= -1,602.10-19 c.
Điện tích của proton :qp= +1.602.10-19 c.
Các điện tích nhỏ bé đó được gọi là các điện tích đơn vị
Electron mang một điện tích đơn vị âm, kí hiệu bằng 1-.
Proton mang một điện tích đơn vị dương, kí hiệu bằng 1+.
Hai, ba, ... điện tích đơn vị dương được kí hiệu bằng 2+, 3+,...
Hai, ba, … điện tích đơn vị âm được kí hiệu bằng 2-. 3-,.. .
9. Giải bài 12.9 trang 30 SBT Hóa học 10
a) Hãy cho biết quan hệ giữa số proton và số electron trong nguyên tử. Tại sao nguyên tử lại trung hoà điện ?
b) Khi nguyên tử nhận thêm hay nhường đi một số electron thì phần tử còn lại có mang điện tích không và được gọi là gì ?
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
a) Trong một nguyên tử, số proton luôn luôn bằng số electron, nghĩa là số điện tích dương và số điện tích âm bằng nhau nên nguyên tử trung hoà điện.
b) Khi nguyên tử nhận thêm hay bỏ ra một số electron thì số proton không còn bằng số electron nữa, nghĩa là số điện tích dương không còn bằng số điện tích âm nên phần tử được hình thành mang điện tích, được gọi là ion.
Nguyên tử hay nhóm nguyên tử mang điện tích được gọi là ion.
10. Giải bài 12.10 trang 30 SBT Hóa học 10
Nguyên tử liti (Z = 3) có bao nhiêu proton, bao nhiêu electron ?
Khi nhường đi một electron thì ion được hình thành mang điện tích dương hay âm ?
lon đó thuộc loại ion gì ? Cho biết tên của ion đó.
Hãy viết phương trình hoá học diễn tả quá trình hình thành ion nói trên.
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
Nguyên tử Li có 3 proton mang điện tích dương và 3 electron mang điện tích âm. Khi mất một electron thì ion có dư một điện tích dương nên ion được hình thành mang một điện tích dương (1+).
Ion mang điện tích dương nên thuộc loại ion dương hay cation
Ion của nguyên tố liti thì được gọi là ion liti (tên nguyên tố).
Phương trình : Li → Li+ + e
11. Giải bài 12.11 trang 30 SBT Hóa học 10
Nguyên tử flo (Z = 9) có bao nhiêu proton, bao nhiêu electron ?
Khi nhận thêm một electron thì ion được hình thành mang điện tích dương hay âm?
lon đó thuộc loại ion gì? Cho biết tên của ion đó.
Hãy viết phương trình hoá học diễn tả quá trình hình thành ion nói trên.
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
Nguyên tử F có 9 proton mang điện tích dương và 9 electron mang điện tích âm. Khi nhận thêm một electron thì ion có dư một điện tích âm nên ion được hình thành mang một điện tích âm (1-).
Ion mang điện tích âm nên thuộc loại ion âm hay anion.
Ion của flo được gọi là ion florua.
Phương trình: F + e → F-
12. Giải bài 12.12 trang 30 SBT Hóa học 10
Hãy viết các phương trình hoá học diễn tả sự hình thành các ion sau: Na+, Mg2+, Al3+, Cl-, O2-, S2-
Phương pháp giải
Ion dương tạo thành do sự cho e
Ion âm tạo thành do sự nhận e
Hướng dẫn giải
Na → Na+ + e
Mg → Mg2+ + 2e
Al → Al3+ + 3e
Cl + 1e → Cl-
O + 2e → O2-
S + 2e → S2-
13. Giải bài 12.13 trang 30 SBT Hóa học 10
Trong hai loại nguyên tố là kim loại và phi kim thì loại nguyên tố nào dễ nhận electron, loại nguyên tố nào dễ nhường electron? Cho thí dụ.
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
Các kim loại dể nhường electron để trở thành ion dương.
Thí dụ :
K → K+ + 1e
Ca → Ca2+ + 2e
Các phi kim dễ nhận electron để trở thành ion âm.
Thí dụ :
Br + e → Br-
I + e → I-
14. Giải bài 12.14 trang 31 SBT Hóa học 10
Viết cấu hình electron nguyên tử của các nguyên tố sau đây : Al, Mg, Na, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử Al, Mg, Na, mỗi nguyên tử nhường mấy electron thì có cấu hình electron giống như của khí hiếm Ne.
Hãy cho biết tại sao các nguyên tử kim loại lại có khuynh hướng nhường electron để trở thành các ion dương ?
Phương pháp giải
Xem lại lý thuyết liên kết ion
Hướng dẫn giải
Cấu hình electron của Al, Mg, Na, Ne:
Al: 1s22s22p6 (3s23p1)
Mg: 1s22s22p6 (3s2)
Na: 1s22s22p6 (3s1)
Ne: 1s22s22p6
Từ các cấu hình trên ta dễ dàng thấy rằng nếu:
nguyên tử Na nhường le để trở thành ion Na+
nguyên tử Mg nhường 2e để trở thành ion Mg2+
nguyên tử Al nhường 3e để trở thành ion Al3+
thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Ta đã biết cấu hình electron của các khí hiếm với 8 electron (đối với He là electron) ở lớp ngoài cùng là một cấu hình electron vững bền. Vì vậy, các nguyên tử kim loại có khuynh hướng dễ nhường electron để có cấu hình electron vững bền của khí hiếm đứng trước.
15. Giải bài 12.15 trang 31 SBT Hóa học 10
Hãy viết cấu hình electron nguyên tử của các nguyên tố sau đây : O, F, Ne. Từ các cấu hình đó hãy cho biết các nguyên tử O, F, mỗi nguyên tử nhận thêm mấy electron thì có cấu hình electron giống như của khí hiếm Ne đứng sau.
Hãy cho biết tại sao các nguyên tử phi kim lại có khuynh hướng nhận thêm electron để trở thành các ion âm ?
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
O: 1s22s22p4
F: 1s22s2p5
Ne: 1s22s22p6
Từ các cấu hình trên ta dễ dàng thấy rằng nếu nguyên tử F nhận thêm 1e để trở thành ion F-, nguyên tử O nhận thêm 2e để trở thành ion O2- thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Như ta đã biết, cấu hình electron của các khí hiếm với 8 electron (đối với He là 2 electron) ở lớp ngoài cùng là một cấu hình electron vững bền (năng lượng thấp). Vì vậy, các nguyên tử phi kim có khuynh hướng nhận electron để có cấu hình electron vững bền của khí hiếm đứng sau.
16. Giải bài 12.16 trang 31 SBT Hóa học 10
Hãy viết cấu hình electron nguyên tử của heli (He) và cấu hình electron của các cation: Be2+, Li+
So sánh cấu hình electron của các cation đó với cấu hình electron nguyên tử của He và cho nhận xét.
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
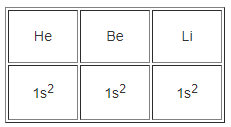
Nhận xét : Các cation Be2+, Li+ có cấu hình electron giống cấu hình electron của nguyên tử khí hiếm He đứng trước.
17. Giải bài 12.17 trang 31 SBT Hóa học 10
Hãy viết cấu hình electron nguyên tử của agon (Ar) và cấu hình electron của các cation: Ca2+, K+
So sánh cấu hình electron của các cation đó với cấu hình electron nguyên tử của Ar và cho nhận xét.
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
Ar: 1s22s22p63s23p6
Ca2+: 1s22s22p63s23p6
K+: 1s22s22p63s23p6
Nhận xét : Các cation Ca2+, K+ có cấu hình electron giống cấu hình electron của nguyên tử khí hiếm Ar đứng trước.
18. Giải bài 12.18 trang 31 SBT Hóa học 10
Hãy viết cấu hình electron nguyên tử của agon (Ar) và cấu hình electron của các anion: S2-, Cl-
Hãy so sánh cấu hình electron của các anion đó với cấu hình electron nguyên tử của Ar và cho nhận xét.
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
Ar: 1s22s22p63s23p6
S2-: 1s22s22p63s23p6
Cl-: 1s22s22p63s23p6
Nhận xét : Các anion S2-, Cl- có cấu hình electron giống cấu hình electron của nguyên tử khí hiếm Ar đứng sau.
19. Giải bài 12.19 trang 31 SBT Hóa học 10
a) Hãy cho biết có hiện tượng gì xảy ra khi cho clo (thường ở dạng Cl2 tác dụng với natri và hãy giải thích sự hình thành liên kết ion trong phân tử NaCl
b) Hãy cho biết thế nào là liên kết ion và bản chất lực liên kết ion là gì ?
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
a) Ta đã biết natri là một kim loại có khuynh hướng nhường electron để trở thành một ion dương có cấu hình electron vững bền và clo là một phi kim có khuynh hướng nhận electron để trở thành một ion âm có cấu hình electron vững bền. Vì vậy khi cho clo tiếp xúc với natri thì trước hết có hiện tượng chuyển electron từ nguyên tử Na sang nguyên tử Cl. Từ đó xuất hiện các ion tích điện khác dấu (âm và dương) và sau đó do lực hút tĩnh điện giữa các ion nên liên kết ion được hình thành.
Phản ứng hoá học giữa natri và clo có thể được diễn tả bằng phương trình hoá học:
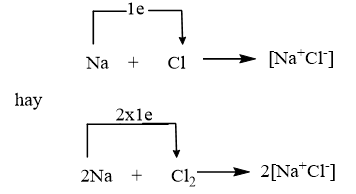
b) Liên kết ion là liên kết giữa các ion, xuất hiện do sự chuyển electron từ nguyên tử kim loại sang nguyên tử phi kim.
Bản chất lực liên kết ion là lực hút tĩnh điện giữa các ion tích điện khác dấu.
20. Giải bài 12.20 trang 31 SBT Hóa học 10
a) Tại sao các hợp chất ion lại thường tồn tại ở trạng thái tinh thể ?
b) Hãy vẽ sơ đồ mạng tinh thể NaCl và hãy mô tả sự phân bố các ion trong mạng tinh thể đó.
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
a) Lực hút tĩnh điện giữa các ion không định hướng: một ion dương có tác dụng hút đối với nhiều ion âm và ngược lại. Vì vậy, các hợp chất ion thường tồn tại ở dạng tinh thể. Các phân tử ion riêng rẽ chỉ tồn tại ở nhiệt độ cao (1440°C đối với NaCl).
b) Hình bên là sơ đồ mạng tinh thể NaCl.
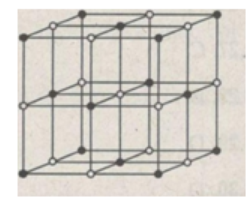
Trong tinh thể NaCl, các ion Na+; Cl- luân phiên phân bố trên các đỉnh của các hình lập phương nhỏ.
Mỗi ion được bao quanh bởi 6 ion khác dấu gần nhất.
21. Giải bài 12.21 trang 31 SBT Hóa học 10
Hãy cho biết tính chất chung của các hợp chất ion.
Phương pháp giải
Xem lại lý thuyết liên kết ion.
Hướng dẫn giải
Vì lực hút tĩnh điện giữa các ion khác dấu lớn nên các tinh thể ion rất bền. Các hợp chất ion khó bay hơi, khó nóng chảy và khá rắn. Thí dụ, muối ăn (NaCl) có nhiệt độ nóng chảy là 800 °C.
Các hợp chất ion dễ tan trong nước. Ở trạng thái rắn, các hợp chất ion không dẫn điện nhưng dung dịch các hợp chất ion hoà tan trong nước và các hợp chất ion ở trạng thái nóng chảy đều là chất dẫn điện vì khi đó các ion tích điện có thể chuyển động tự do. Đó là đặc điểm của các hợp chất ion.
22. Giải bài 12.22 trang 31 SBT Hóa học 10
Ba nguyên tử X, Y, Z có tổng điện tích hạt nhân bằng 16, nguyên tử X nhiều hơn nguyên tử Y một e. Tổng số e trong ion (XY3)- là 32. Xác định X, Y, Z.
Phương pháp giải
Gọi số e trong mỗi nguyên tử X, Y, Z lần lượt là x, y, z. Theo đề bài ta có hệ phương trình đại số:
x + y + z = 16 và x - y = 1 và 3x + y + 1 = 32
Giải hệ phương trình ta thu được x, y, z
Hướng dẫn giải
Gọi số e trong mỗi nguyên tử X, Y, Z lần lượt là x, y, z. Theo đề bài ta có hệ phương trình đại số:
x + y + z = 16 và x - y = 1 và 3x + y + 1 = 32
Vậy x = 8 (O); y = 7 (N) và Z = 1 (H)
