Giải bài tập SBT Hóa 10 Bài 36: Tốc độ phản ứng hóa học
Nhằm mục đích kiểm tra kiến thức về Tốc độ phản ứng hóa học cũng như cách vận dụng tích chất để giải bài tập. eLib xin giới thiệu đến các em học sinh nội dung giải bài tập dưới đây. Với các bài tập có phương pháp và lời giải chi tiết, hi vọng rằng đây sẽ là tài liệu giúp các bạn học tập tốt hơn.
Mục lục nội dung
1. Giải bài 36.1 trang 79 SBT Hóa học 10
2. Giải bài 36.2 trang 79 SBT Hóa học 10
3. Giải bài 36.3 trang 79 SBT Hóa học 10
4. Giải bài 36.4 trang 79 SBT Hóa học 10
5. Giải bài 36.5 trang 80 SBT Hóa học 10
6. Giải bài 36.6 trang 80 SBT Hóa học 10
7. Giải bài 36.7 trang 80 SBT Hóa học 10
8. Giải bài 36.8 trang 81 SBT Hóa học 10

1. Giải bài 36.1 trang 79 SBT Hóa học 10
Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat. Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng ?
A. Nung kali clorat tinh thể ở nhiệt độ cao.
B. Nung hỗn hợp kali clorat tinh thể và mangan đioxit ở nhiệt độ cao.
C. Đun nóng nhẹ kali clorat tinh thể.
D. Đun nóng nhẹ dung dịch kali clorat bão hoà.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng.
Trong phòng thí nghiệm, người ta nung hỗn hợp kali clorat tinh thể và mangan đioxit ở nhiệt độ cao.
Hướng dẫn giải
Nung hỗn hợp kali clorat tinh thể và mangan đioxit ở nhiệt độ cao.
2KClO3 →(to, MnO2) 2KCl + 2O2
→ Đáp án B
2. Giải bài 36.2 trang 79 SBT Hóa học 10
Để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng hoá học người ta dùng đại lượng nào sau đây ?
A. Độ tăng khối lượng sản phẩm.
B. Tốc độ phản ứng.
C. Độ tăng khối lượng chất tham gia phản ứng.
D. Thể tích chất tham gia phản ứng.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng.
Hướng dẫn giải
Để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng hoá học người ta dùng tốc độ phản ứng.
→ Chọn B
3. Giải bài 36.3 trang 79 SBT Hóa học 10
Đại lượng đặc trưng cho đô biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian gọi là
A. tốc độ phản ứng.
B. cân bằng hoá học.
C. tốc độ tức thời.
D. quá trình hoá học.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng.
Hướng dẫn giải
Đại lượng đặc trưng cho đô biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian gọi là tốc độ phản ứng.
→ Chọn A
4. Giải bài 36.4 trang 79 SBT Hóa học 10
Trường hợp nào sau đây có yếu tố làm giảm tốc độ phản ứng ?
A. Đưa lưu huỳnh đang cháy ngoài không khí vào bình chứa khí oxi.
B. Quạt bếp than đang cháy.
C. Thay hạt nhôm bằng bột nhôm để cho tác dụng với dung dịch HCl.
D. Dùng dung dịch loãng các chất tham gia phản ứng.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng.
Các yếu tố ảnh hưởng đến tốc độ phản ứng: nhiệt độ, áp suất, xúc tác, diện tích tiếp xúc, nồng độ.
Hướng dẫn giải
Đáp án D
Các yếu tố ảnh hưởng đến tốc độ phản ứng: nhiệt độ, áp suất, xúc tác, diện tích tiếp xúc, nồng độ.
⇒ Dung dịch loãng ⇒ nồng độ nhỏ ⇒ tốc độ phản ứng chậm.
5. Giải bài 36.5 trang 80 SBT Hóa học 10
Trong các câu sau, câu nào sai ?
A. Nhiên liệu cháy ở tầng khí quyển trên cao nhanh hơn khi cháy ở mặt đất.
B. Nước giải khát được nén CO2 và ở áp suất cao hơn sẽ có độ chua (độ axit) lớn hơn.
C. Thực phẩm được bảo đảm ở nhiệt độ thấp hơn sẽ giữ được lâu hơn.
D. Thực phẩm nấu trong nồi áp suất là để có nhiệt độ cao hơn 100°C.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng.
Càng lên cao không khí càng loãng, nhiên liệu cháy chậm hơn
Hướng dẫn giải
Đáp án A
A. Nhiên liệu cháy ở tầng khí quyển trên cao nhanh hơn khi cháy ở mặt đất.
⇒ Sai, trên cao không khí càng loãng, áp suất giảm, nhiệt độ giảm ⇒ tốc độ phản ứng chậm
B. Nước giải khát được nén
⇒ Đúng. Áp suất cao ⇒ CO2 được nén nhiều hơn ⇒ độ axit lớn hơn.
C. Thực phẩm được bảo đảm ở nhiệt độ thấp hơn sẽ giữ được lâu hơn.
⇒ Đúng. Nhiệt độ thấp phản ứng thực phẩm với oxi không khí có tốc độ thấp ⇒ tránh ôi thiu.
D. Thực phẩm nấu trong nồi áp suất là để có nhiệt độ cao hơn 100°C.
⇒ Đúng.
6. Giải bài 36.6 trang 80 SBT Hóa học 10
Trong các câu sau, câu nào đúng ?
A. Khi nồng độ chất phản ứng tăng thì tốc độ phản ứng tăng.
B. Khi nồng độ chất phản ứng giảm thì tốc độ phản ứng tăng.
C. Khi nồng độ chất phản ứng tăng thì tốc độ phản ứng giảm.
D. Nồng độ chất phản ứng không ảnh hưởng đến tốc độ phản ứng.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng.
Các yếu tố ảnh hưởng đến tốc độ phản ứng: nhiệt độ, áp suất, xúc tác, diện tích tiếp xúc, nồng độ.
Hướng dẫn giải
Đáp án A
Khi nồng độ chất phản ứng tăng thì tốc độ phản ứng tăng.
7. Giải bài 36.7 trang 80 SBT Hóa học 10
Các yếu tố như nhiệt độ, áp suất chất khí, chất xúc tác và diện tích bề mặt chất rắn có ảnh hưởng lớn đến tốc độ phản ứng hoá học. Tuỳ theo phản ứng hoá học cụ thể mà vận dụng một, một số hay tất cả các yếu tố trên để tăng hay giảm tốc độ phản ứng. Trong những trường hợp dưới đây, yếu tố nào trong số các yếu tố trên ảnh hưởng đến tốc độ phản ứng ?
a) Sự cháy diễn ra mạnh và nhanh hơn khi đưa lưu huỳnh đang cháy ngoài không khí vào lọ đựng khí oxi.
b) Khi cần ủ bếp than, người ta đậy nắp bếp lò làm cho phản ứng cháy của than chậm lại.
c) Phản ứng oxi hoá lưu huỳnh đioxit tạo thành lưu huỳnh trioxit diễn ra nhanh hơn khi có mặt vanađi oxit (V2O5)
d) Nhôm bột tác dụng với dung dịch axit clohiđric nhanh hơn so với nhôm dây.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng.
Các yếu tố ảnh hưởng đến tốc độ phản ứng: nhiệt độ, áp suất, xúc tác, diện tích tiếp xúc, nồng độ.
Hướng dẫn giải
Các yếu tố ảnh hưởng đến tốc độ phản ứng trong mỗi trường hợp đã cho là:
a) Không khí chỉ có 20% oxi ⇒ khi cho vào bình oxi ⇒ Tăng nồng độ khí oxi lên 5 lần (chất tham gia phản ứng) ⇒ làm tăng tốc độ phản ứng.
b) Đậy nắp bếp lò ⇒ giảm không khí từ ngoài vào ⇒ Giảm nồng độ chất tham gia phản ứng (khí oxi) ⇒ làm giảm tốc độ phản ứng.
c)
d) Giảm kích thước hạt ⇒ diện tích tiếp xúc của nhôm với axit tăng ⇒ tăng tốc độ phản ứng.
8. Giải bài 36.8 trang 81 SBT Hóa học 10
Bảng số liệu sau đây cho biết thể tích khí hiđro thu được theo thời gian của phản ứng giữa kẽm (dư) với axit clohiđric.
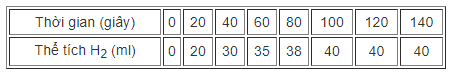
a) Hãy vẽ đồ thị biểu diễn sự phụ thuộc thể tích khí hiđro theo thời gian.
Từ đồ thị hãy cho biết khoảng thời gian nào phản ứng xảy ra nhanh nhất ?
Ở thời điểm phản ứng kết thúc, hình dạng đồ thị như thế nào ?
b) Nếu xác định được nồng độ của axit clohiđric theo thời gian phản ứng thì đồ thị biểu diễn sự phụ thuộc đó có dạng như thế nào ?
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng
Hướng dẫn giải
a)
.png)
Từ 0 giây đến 20 giây là đoạn đồ thị dốc nhất, đó là khoảng thời gian phản ứng có tốc độ cao nhất.
Ở thời điểm phản ứng kết thúc, đồ thị nằm ngang, thể tích hiđro thu được là cực đại 40 ml. Tại thời điểm đó axit clohiđric đã phản ứng hết.
b) Dạng đồ thị biểu diễn sự phụ thuộc của nồng độ axit HCl theo thời gian
.png)
9. Giải bài 36.9 trang 81 SBT Hóa học 10
Hãy cho biết người ta đã sử dụng biện pháp nào để tăng tốc độ phản ứng hoá học trong các trường hợp sau đây :
a) Rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn.. ) để ủ rượu.
b) Tạo thành những lỗ rỗng trong viên than tổ ong.
c) Nén hỗn hợp khí nitơ và hiđro ở áp suất cao để tổng hợp amoniac.
d) Nung hỗn hợp bột đá vôi, đất sét và thạch cao ở nhiệt độ cao để sản xuất clinke trong công nghiệp sản xuất xi măng.
e) Dùng phương pháp ngược dòng trong sản xuất axit sunfuric.
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng, phân tích nhận định để đưa ra phương pháp phù hợp
Hướng dẫn giải
a) Men rượu là một loại xúc tác sinh học. Chất xúc tác đã được sử dụng để tăng tốc độ của phản ứng hoá học.
b) Những lỗ rỗng trong viên than tổ ong làm tăng diện tích tiếp xúc giữa than và oxi không khí, do đó làm tăng tốc độ của phản ứng hoá học.
c) Nén hỗn hợp khí nitơ và hiđro ở áp suất cao để tăng nồng độ của hai chất khí, làm tăng tốc độ của phản ứng hoá học.
d) Dùng biện pháp tăng nhiệt độ để tăng tốc độ của phản ứng hoá học.
e) Dùng phương pháp ngược dòng, anhiđrit sunfuric đi từ dưới lên, axit sunfuric 98% đi từ trên đỉnh tháp hấp thụ xuống để tăng diện tích tiếp xúc giữa các chất, do đó, làm tăng tốc độ của phản ứng hoá học.
10. Giải bài 36.10 trang 81 SBT Hóa học 10
Trong mỗi cặp phản ứng sau, phản ứng nào có tốc độ lớn hơn ?
a) Fe + dung dịch HCl 0,1M và Fe + dung dịch HCl 2M ở cùng một nhiệt độ.
b) Al + dung dịch NaOH 2M ở 25°C và Al + dung dịch NaOH 2M ở 50°C.
c) Zn (hạt) + dung dịch HCl 1M ở 25°C và Zn (bột) + dung dịch HCl 1M ở 25°C
d) Nhiệt phân riêng và nhiệt phân hỗn hợp KClO3 với MnO2
Phương pháp giải
Xem lại lý thuyết về tốc độ phản ứng, phân tích nhận định để đưa ra phương pháp phù hợp
Hướng dẫn giải
a) Ở cùng một nhiệt độ, cặp chất Fe + dung dịch HCl 0,1M có tốc độ phản ứng xảy ra chậm hơn so với cặp chất Fe + dung dịch HCl 2M, do nồng độ HCl nhỏ hơn.
b) Hai cặp chất Al + dung dịch NaOH 2M ở 25 °C và Al + dung dịch NaOH 2M ở 50 °C chỉ khác nhau về nhiệt độ. Cặp chất thứ hai có nhiệt độ cao hơn nên có tốc độ phản ứng cao hơn.
c) Hai cặp chất Zn (hạt) + dung dịch HCl 1M ở 25 °C và Zn (bột) + dung dịch HCl 1M ở 25°C chỉ khác nhau về kích thước hạt. Cặp chất thứ hai có kích thước hạt nhỏ hơn, do đó có tổng diện tích bề mặt lớn hơn và tốc độ phản ứng cao hơn.
d) Nhiệt phân KClO3 và nhiệt phân hỗn hợp KClO3 với MnO2. Trường hợp thứ hai có xúc tác nên có tốc độ phản ứng cao hơn.
