Giải bài tập SBT Hóa 10 Bài 21: Khái quát về nhóm halogen
Dưới đây là nội dung chi tiết Giải bài tập SBT Hóa 10 Chương 4 Khái quát về nhóm halogen, với hướng dẫn giải chi tiết, rõ ràng, trình bày khoa học. eLib hy vọng đây sẽ là tài liệu hữu ích giúp các bạn học sinh lớp 10 học tập thật tốt !
Mục lục nội dung
1. Giải bài 21.1 trang 50 SBT Hóa học 10
2. Giải bài 21.2 trang 50 SBT Hóa học 10
3. Giải bài 21.3 trang 50 SBT Hóa học 10
4. Giải bài 21.4 trang 50 SBT Hóa học 10
5. Giải bài 21.5 trang 51 SBT Hóa học 10
6. Giải bài 21.6 trang 51 SBT Hóa học 10
7. Giải bài 21.7 trang 51 SBT Hóa học 10
8. Giải bài 21.8 trang 51 SBT Hóa học 10
9. Giải bài 21.9 trang 51 SBT Hóa học 10

1. Giải bài 21.1 trang 50 SBT Hóa học 10
Những nguyên tố ở nhóm nào sau đây có cấu hình electron lớp ngoài cùng là ns2np5
A. Nhóm IVA.
B. Nhóm VA.
C. Nhóm VIA.
D. Nhóm VIIA.
Phương pháp giải
Xem lại lý thuyết nhóm halogen
Hướng dẫn giải
Các nguyên tố có cấu hình electron lớp ngoài cùng là ns2np5 có 7e lớp ngoài cùng, là nguyên tố p
→ Các nguyên tố thuộc nhóm VIIA
→ Chọn D
2. Giải bài 21.2 trang 50 SBT Hóa học 10
Các nguyên tử halogen đều có
A. 3e ở lớp electron ngoài cùng.
B. 5e ở lớp electron ngoài cùng,
C. 7e ở lớp electron ngoài cùng.
D. 8e ở lớp electron ngoài cùng.
Phương pháp giải
Xem lại lý thuyết nhóm halogen.
Hướng dẫn giải
Các nguyên tố halogen thuộc nhóm VIIA nên có 7e lớp ngoài cùng.
→ Chọn C
3. Giải bài 21.3 trang 50 SBT Hóa học 10
Đặc điểm nào sau đây là đặc điểm chung của các nguyên tố halogen (F, Cl, Br, I)?
A. Ở điều kiện thường là chất khí.
B. Có tính oxi hóa mạnh.
C. Vừa có tính oxi hóa, vừa có tính khử.
D. Tác dụng mạnh với nước.
Phương pháp giải
Xem lại lý thuyết nhóm halogen.
Hướng dẫn giải
Các nguyên tố halogen có đặc điểm chung là tính oxi hóa mạnh
→ Chọn B
4. Giải bài 21.4 trang 50 SBT Hóa học 10
Tính chất nào sau đây không phải là tính chất chung của các nguyên tố nhóm halogen?
A. Nguyên tử có khả năng thu thêm 1 electron.
B. Tác dụng với hiđro tạo thành hợp chất có liên kết cộng hóa trị có cực
C. Có số oxi hóa -1 trong mọi hợp chất.
D. Lớp electron ngoài đều có 7 electron.
Phương pháp giải
Xem lại lý thuyết nhóm halogen.
Hướng dẫn giải
A. Đúng vì các nguyên tố halogen có cấu hình e lớp ngoài cùng là ns2np5 dễ thu thêm 1e để trở thành cấu hình e của khí hiếm.
B. Đúng vì trong HX, các nguyên tố halogen có độ âm điện lớn hơn H nhiều.
C. Sai vì chỉ có F có số oxi hóa -1 trong mọi hợp chất.
D. Đúng vì nguyên tố halogen thuộc nhóm VIIA nên có 7e lớp ngoài cùng.
→ Chọn C.
5. Giải bài 21.5 trang 51 SBT Hóa học 10
Trong các phản ứng hóa học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron?
A. Nhận thêm 1 electron.
B. Nhận thêm 2 electron.
C. Nhường đi 1 electron.
D. Nhường đi 7 electron.
Phương pháp giải
Xem lại lý thuyết nhóm halogen.
Hướng dẫn giải
Các nguyên tố halogen có cấu hình e lớp ngoài cùng là ns2np5 nên dễ thu thêm 1e để trở thành cấu hình e của khí hiếm.
→ Chọn A
6. Giải bài 21.6 trang 51 SBT Hóa học 10
Xác định các chất trong sơ đồ chuyển hoá sau:
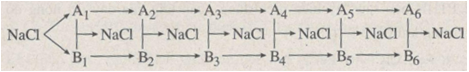
Phương pháp giải
Xem lại lý thuyết nhóm halogen.
Hướng dẫn giải
A1, B1 là Na, Cl2
A2, B2 là Na2O, HCl
A3, B3 là NaOH, CaCl2
A4, B4 là Na2CO3, ZnCl2
A5, B5 là Na3PO4, MgCl2
A6, B6 là Na2SO4, BaCl2
7. Giải bài 21.7 trang 51 SBT Hóa học 10
Một nguyên tố halogen có cấu hình electron lớp ngoài cùng của nguyên tử là 4s24p5
a) Viết cấu hình electron đầy đủ của nguyên tử nguyên tố đó.
b) Cho biết tên, kí hiệu hoá học và cấu tạo phân tử của đơn chất halogen này.
c) Nêu tính hoá học cơ bản của nguyên tố trên.
d) So sánh tính chất hoá học của nguyên tố này với 2 nguyên tố halogen khác đứng trên và dưới nó trong nhóm halogen.
Phương pháp giải
Xem lại lý thuyết nhóm halogen.
Hướng dẫn giải
a) 1s22s22p63s23p64s24p5
b) Đó là brom, kí hiệu hoá học là Br, phân tử gồm 2 nguyên tử liên kết với nhau bằng 1 liên kết cộng hoá trị.
c) Tính chất hoá học cơ bản là tính oxi hoá mạnh.
d) Brom có tính oxi hoầ yếu hơn clo nhưng mạnh hơn iot.
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
8. Giải bài 21.8 trang 51 SBT Hóa học 10
Viết PTHH của các phản ứng xảy ra khi cho clo và iot lần lượt tác dụng với dung dịch KOH ở nhiệt độ thường. Giải thích vì sao có sự khác nhau ở 2 phản ứng đó.
Phương pháp giải
Xem lại lý thuyết nhóm halogen.
Hướng dẫn giải
Cl2 + 2KOH → KCl + KClO + H2O
3I2 + 6KOH → 5KI + KIO3 + 3H2O
Trong môi trường kiềm, ion XO- phân huỷ theo phản ứng sau :
3XO- → 2X- + XO3- (kí hiệu X là halogen)
Ion ClO- phân huỷ rất chậm ở nhiệt độ thường, phân huỷ nhanh ở nhiệt độ trên 75°C
Ion IO- phân huỷ ở tất cả các nhiệt độ trên, do đó ở nhiệt độ thường, ta có 2 phản ứng trên.
9. Giải bài 21.9 trang 51 SBT Hóa học 10
Cho 5 gam brom có lẫn tạp chất là clo vào một dung dịch chứa 1,600 gam KBr. Sau phản ứng làm bay hơi dung dịch thì thu được 1,155 gam chất rắn khan. Xác định % về khối lượng của clo trong 5 gam brom đem phản ứng.
Phương pháp giải
Khối lượng muối giảm là :
1,600 - 1,155 = 0,445 (g)
Cl2 + 2KBr → 2KCl + Br2
238 g 149 g
71g khối lượng muối giảm đi 89 g
xg 0,445 g
→ \(\dfrac{{71}}{x} = \dfrac{{89}}{{0,445}} \)
Hướng dẫn giải
Khối lượng muối giảm là :
1,600 - 1,155 = 0,445 (g)
Cl2 + 2KBr → 2KCl + Br2
71g 238g 149g khối lượng muối giảm đi 89g
xg 0,445 g
Ta có:
\(\frac{{71}}{x} = \frac{{89}}{{0,445}} \to x = \frac{{71.0,445}}{{89}} = 0,355g\)
\(\% {m_{Cl}} = \frac{{0,355}}{5}.100\% = 7,1\% \)
10. Giải bài 21.10 trang 51 SBT Hóa học 10
Khi cho 20m3 không khí có chứa khí clo đi qua một ống đựng muối KBr, khối lượng của muối đó giảm bớt 178 mg. Xác định làm lượng của khí clo (mg/m3) trong không khí.
Phương pháp giải
Cl2 + 2KBr → 2KCl + Br2
1 mol 238 g 149 g 1 mol; khối lượng muối giảm 89 g
x mol 0,178g
\( \Rightarrow x = \dfrac{{0,178}}{{89}}\)
Hàm lượng của khí clo trong không khí là:
\(\dfrac{{71x.1000}}{{20}}\)
Hướng dẫn giải
Cl2 + 2KBr → 2KCl + Br2
1mol 238g 149g 1 mol; khối lượng muối giảm 89g
x mol
0,178g
x = 0,178/89 = 0,002 mol
Lượng khí clo có trong 20m3 không khí là :
71.0,002 = 0,0142 (g) hay 14,2 mg
Hàm lượng của khí clo trong không khí là: 14,2/20 = 7,1 (mg/m3)
11. Giải bài 21.11 trang 51 SBT Hóa học 10
Có 2 khí không màu, dễ tan trong nước, dung dịch thu được cho tác dụng với dung dịch AgNO3 tạo ra kết tủa màu vàng
a) Cho biết tên 2 khí đó.
b) Hãy phân biệt 2 khí đó bằng phương pháp hoá học.
Phương pháp giải
Xem lại lý thuyết nhóm halogen
Hướng dẫn giải
a) Hai khí đó là HBr và HI
HBr + AgNO3 → AgBr + HNO3
HI + AgNO3 → AgI + HNO3
b) Dẫn từng khí đó đi qua nước clo có pha sẵn hồ tinh bột, chất nào tạo ra chất mới có màu xanh là HI.
Cl2 + HI → 2HCl + I2
Tham khảo thêm
- doc Giải bài tập SBT Hóa 10 Bài 22: Clo
- doc Giải bài tập SBT Hóa 10 Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
- doc Giải bài tập SBT Hóa 10 Bài 24: Sơ lược về hợp chất có oxi của clo
- doc Giải bài tập SBT Hóa 10 Bài 25: Flo - Brom - Iot
- doc Giải bài tập SBT Hóa 10 Bài 26: Luyện tập: Nhóm halogen
