Giải bài tập SBT Hóa 10 Bài 29: Oxi - Ozon
Hướng dẫn Giải bài tập SBT Hóa học 10 Bài 29 dưới đây sẽ giúp các em học sinh nắm vững phương pháp giải bài tập về oxi-ozon và ôn luyện tốt kiến thức. Mời các em cùng theo dõi.
Mục lục nội dung
1. Giải bài 29.1 trang 63 SBT Hóa học 10
2. Giải bài 29.2 trang 63 SBT Hóa học 10
3. Giải bài 29.3 trang 63 SBT Hóa học 10
4. Giải bài 29.4 trang 64 SBT Hóa học 10
5. Giải bài 29.5 trang 64 SBT Hóa học 10
6. Giải bài 29.6 trang 64 SBT Hóa học 10
7. Giải bài 29.7 trang 64 SBT Hóa học 10
8. Giải bài 29.8 trang 64 SBT Hóa học 10
9. Giải bài 29.9 trang 65 SBT Hóa học 10
10. Giải bài 29.10 trang 65 SBT Hóa học 10
11. Giải bài 29.11 trang 65 SBT Hóa học 10
12. Giải bài 29.12 trang 65 SBT Hóa học 10
13. Giải bài 29.13 trang 65 SBT Hóa học 10
14. Giải bài 29.14 trang 65 SBT Hóa học 10

1. Giải bài 29.1 trang 63 SBT Hóa học 10
Khác với nguyên tử O, ion oxit O2- có
A. bán kính ion nhỏ hơn và ít electron hơn.
B. bán kính ion nhỏ hơn và nhiều electron hơn.
C. bán kính ion lớn hơn và ít electron hơn.
D. bán kính ion lớn hơn và nhiều electron hơn.
Phương pháp giải
Xem lại lý thuyết về oxi - ozon.
Hướng dẫn giải
So sánh bán kính nguyên tử với ion cùng loại:
- Nếu là ion dương (cation) sẽ có ít electron hơn nguyên tử, và bán kính của ion dương nhỏ hơn bán kính nguyên tử.
- Nếu là ion âm (anion) sẽ có nhiều electron hơn nguyên tử và bán kính của ion âm lớn hơn bán kính nguyên tử.
Đáp án D
2. Giải bài 29.2 trang 63 SBT Hóa học 10
Cấu hình electron nào ở cột bên trái tương ứng với nguyên tử nào ở cột bên phải ?
Cấu hình electron
a) 1s22s2p4
b) 1s22s22p63s23p4
c) 1s22s22p5
d) 1s22s22p63s23p5
Nguyên tử
1. S
2. O
3. Cl
4. F
5. P
Phương pháp giải
Xem lại lý thuyết về oxi - ozon.
Hướng dẫn giải
A. Z = 8 → là oxi
B. Z = 16 → là lưu huỳnh
C. Z = 7 → là flo
D. Z = 17 → là clo
→ A-b, B-a, C-d, D-c
3. Giải bài 29.3 trang 63 SBT Hóa học 10
Khí oxi điều chế được có lẫn hơi nước. Dẫn khí oxi ẩm đi qua chất nào sau đây để được khí oxi khô ?
A. Al2O3
B. CaO
C. Dung dịch Ca(OH)2
D. Dung dịch HCl
Phương pháp giải
Xem lại lý thuyết về oxi - ozon.
Hướng dẫn giải
Để làm khô khí oxi dùng CaO rắn
→ Chọn B
4. Giải bài 29.4 trang 64 SBT Hóa học 10
Ở một số nhà máy nước, người ta dùng ozon để sát trùng nước máy là dựa vào tính chất nào sau đây của ozon ?
A. Ozon là một khí độc
B. Ozon không tác dụng với nước
C. Ozon tan nhiều trong nước
D. Ozon là chất oxi hoá mạnh
Phương pháp giải
Xem lại lý thuyết về oxi - ozon.
Hướng dẫn giải
Ozon có tính oxi hóa mạnh nên được dùng để khử trùng nước máy
→ Chọn D
5. Giải bài 29.5 trang 64 SBT Hóa học 10
Với số mol các chất bằng nhau, chất nào dưới đây điều chế được lượng O2 nhiều nhất
A. 2KNO3 → 2KNO2 + 2O2
B. 2KClO3 → 2KCl + 3O2
C. 2H2O2 → 2H2O + O2
D. 2HgO → 2Hg + O2
Phương pháp giải
Tính số mol O2 theo mỗi PTHH
Hướng dẫn giải
A. 1mol KNO3 → 0,5 mol O2
B. 1 mol KClO3 → 1,5 mol O2
C. 1 mol H2O2 → 0,5 mol O2
D. 1 mol HgO → 0,5 mol O2
→ Chọn B
6. Giải bài 29.6 trang 64 SBT Hóa học 10
Oxi có số oxi hóa dương trong hợp chất nào sau đây
A. K2O
B. OF2
C. H2O2
D. (NH4)2SO4
Phương pháp giải
Xem lại lý thuyết về oxi - ozon. Tại đây
Hướng dẫn giải
Oxi có số oxi hóa dương trong hợp chất OF2
7. Giải bài 29.7 trang 64 SBT Hóa học 10
Khi nhiệt phân 1g KMnO4 thì thể tích khí O2 thu được ở đktc là
A. 0,1 lít
B. 0,3 lít
C. 0,07 lít
D. 0,03 lít
Phương pháp giải
Tính số mol KMnO4
Tính số mol theo PTHH: 2KMnO4 → K2MnO4 + MnO2 + O2
Hướng dẫn giải
\({n_{KMn{O_4}}} = \dfrac{1}{{158}}(mol)\)
\( \Rightarrow {n_{{O_2}}} = \dfrac{1}{2}{n_{KMn{O_4}}} = \dfrac{1}{{316}} \approx 0,00316(mol) \Rightarrow {V_{{O_2}}} = 0,07(l)\)
→ Chọn C
8. Giải bài 29.8 trang 64 SBT Hóa học 10
Điều chế khí oxi bằng cách nhiệt phân KMnO4. Kết quả của thí nghiệm được ghi lại như sau:
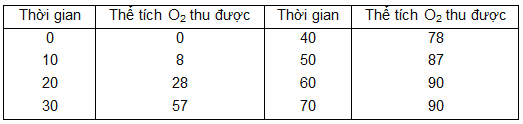
a) Vẽ đồ thị biểu diễn thể tích khí oxi thu được theo thời gian (trục tung là thể tích khí oxi, trục hoành là thời gian).
b) Dùng đồ thị để cho biết thể tích khí oxi thu được ở thời điểm :
- 25 giây
- 45 giây
c) Ở thời điểm nào thì phản ứng kết thúc ?
Phương pháp giải
Vẽ đồ thị với trục tung là thể tích khí oxi, trục hoàng là thời gian. Dựa vào đồ thì trả lời các câu hỏi.
Hướng dẫn giải
a) Xem đồ thị sau:
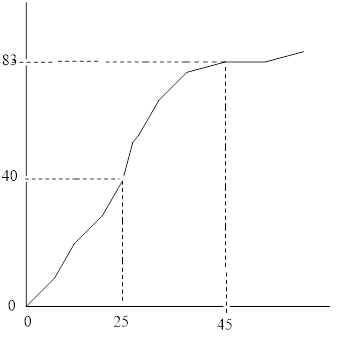
b) Thể tích khí oxi thu được ở các thời điểm :
25 giây: Khoảng 40 cm3
45 giây: Khoảng 83 cm3
c) Phản ứng kết thúc ở thời điểm 60 giây và thể tích khí oxi thu được là 90 cm3
9. Giải bài 29.9 trang 65 SBT Hóa học 10
a) Cho biết tên hai dạng thù hình của nguyên tố oxi.
b) So sánh tính chất hoá học của hai dạng thù hình. Dẫn ra PTHH để minh hoạ.
Phương pháp giải
Xem lại lý thuyết về oxi - ozon. Tại đây
Hướng dẫn giải
a) Hai dạng thù hình của nguyên tố oxi là oxi O2 và ozon O3
b) So sánh tính chất hoá học của oxi và ozon
* Oxi:
- Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Ag, Au và Pt) → oxit. Các phản ứng thường xảy ra ở nhiệt độ cao.
2Mg + O2 → 2MgO
3Fe + O2 → Fe3O4
- Tác dụng với phi kim
+ Oxi phản ứng với hầu hết các phi kim (trừ halogen) tạo thành oxit axit hoặc oxit không tạo muối.
+ Các phản ứng thường xảy ra ở nhiệt độ cao.
S + O2 → SO2
C + O2 → CO2
2C + O2 → 2CO
N2 + O2
- Tác dụng với hợp chất có tính khử
2CO + O2 → 2CO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
* Ozon
Có tính oxi hóa mạnh hơn Oxi:
O3 + 2KI + H2O → 2KOH + I2 + O2
2Ag + O3 → Ag2O + O2 (phản ứng xảy ra ngay ở nhiệt độ thường).
10. Giải bài 29.10 trang 65 SBT Hóa học 10
Có một hỗn hợp khí gồm oxi và ozon. Hỗn hợp khí này có ti khối đối với hiđro bằng 18. Hãy xác định thành phần phần trăm theo thể tích của hỗn hợp khí.
Phương pháp giải
Khối lượng mol trung bình của hỗn hợp khí:
\(\overline M = {\rm{ }}18.2 = 36\left( {g/mol} \right)\)
Đặt x và y là số mol \(O_3\) và \(O_2\)có trong 1 mol hỗn hợp khí, ta có phương trình đại số :
\(\dfrac{{48x + 32y}}{{x + y}} = 36\)
Giải phương trình, ta có y = 3x
Hướng dẫn giải
Khối lượng mol trung bình của hỗn hợp khí:
M = 18 x 2 = 36(g/mol)
Đặt x và y là số mol O3 và O2 có trong 1 mol hỗn hợp khí, ta có phương trình đại số :
(48x + 32y) : (x + y) = 36
Giải phương trình, ta có y = 3x. Biết rằng tỉ lệ phần trăm về số mol khí cũng là tỉ lệ về thể tích, thể tích khí oxi gấp 3 lần thể tích khí ozon. Thành phần của hỗn hợp khí là 25% ozon và 75% oxi.
11. Giải bài 29.11 trang 65 SBT Hóa học 10
Hỗn hợp khí A gồm có O2 và O3 tỉ khối của hỗn hợp khí A đối với khí H2 là 19,2. Hỗn hợp khí B gồm có H2 và khí CO, tỉ khối của hỗn hợp khí B đối với H2 là 3,6
a) Tính thành phần phần trăm theo thể tích của mỗi khí có trong hỗn hợp khí A và B.
b) Một mol khí A có thể đốt cháy hoàn toàn bao nhiêu mol khí CO ?
Phương pháp giải
a) Đặt x và y là số mol O3 và O2 có trong 1 mol hỗn hợp khí
Hỗn hợp khí A : \(\dfrac{{48x + 32y}}{{x + y}} = 38,4\)
→ 3x = 2y
Đặt x và y là số mol H2 và CO có trong 1 mol hỗn hợp khí
Hỗn hợp khí B: \(\dfrac{{2x + 28y}}{{x + y}} = 7,2\)
→ x = 4y
b) PTHH của các phản ứng :
2CO + O2 → 2CO2 (1)
3CO + O3 → 3CO2 (2)
Tính toán theo PTHH
Hướng dẫn giải
a) Đặt x và y là số mol O3 và O2 có trong 1 mol hỗn hợp khí
Hỗn hợp khí A : (48x + 32y)/(x+y) = 19,2 x 2 = 38,4
→ 3x = 2y → 40%O3 và 60% O2
a) Đặt x và y là số mol H2 và CO có trong 1 mol hỗn hợp khí
Hỗn hợp khí B : (2x + 28y)/(x+y) = 3,6 x 2 = 7,2
→ x = 4y → 80% H2 và 20% CO
b) PTHH của các phản ứng :
2CO + O2 → 2CO2 (1)
3CO + O3 → 3CO2 (2)
Trong 1 mol hỗn hợp khí A có 0,6 mol O3 và 0,4 mol O2
Theo (1): 0,6 mol O2 đốt cháy được 1,2 mol CO.
Theo (2) : 0,4 mol O3 đốt cháy được 1,2 mol CO.
Kết luận: 1 mol hỗn hợp khí A đốt cháy được 2,4 mol khí CO.
12. Giải bài 29.12 trang 65 SBT Hóa học 10
Sau khi ozon hoá một thể tích oxi thì thấy thể tích giảm đi 5 ml. Tính thể tích ozon đã được tạo thành và thể tích oxi đã tham gia phản ứng để biến thành ozon. Các thể tích khí đều đo ở đktc.
Phương pháp giải
3O2 → 2O3
3ml → 2 ml (giảm 1 ml)
y ml ←x ml (giảm 5 ml)
Rút ra : x = 10 ml và y = 15 ml
Hướng dẫn giải
3O2 → 2O3
3ml → 2 ml (giảm 1 ml)
y ml ←x ml (giảm 5 ml)
Rút ra : x = 10 ml và y = 15 ml
Thể tích O3 đã tạo thành là 10 ml.
Thể tích O2 đã tham gia phản ứng là 15 ml.
13. Giải bài 29.13 trang 65 SBT Hóa học 10
Một bình cầu dung tích 448 ml được nạp oxi rồi cân. Phóng điện để ozon hoá, sau đó lại nạp oxi rồi cân. Khối lượng trong 2 trường hợp chênh lệch nhau 0,03 gam.
Tính phần trăm về khối lượng của ozon trong hỗn hợp sau phản ứng. Biết các thể tích khí nạp vào bình đều đo ở đktc.
Phương pháp giải
Số mol ozon có trong oxi đã được ozon hoá :
\(\dfrac{{0,03}}{{16}} = 0,001875\) (mol) hay 0,09 (g).
Số mol oxi có trong bình : 0,02 - 0,001875 = 0,018125 (mol) hay 0,58 g.
Khối lượng của hỗn hợp : 0,09 + 0,58 = 0,67 (g).
Tính % khối lượng ozon
Hướng dẫn giải
448 ml ở đktc là 0,02 mol.
Số mol ozon có trong oxi đã được ozon hoá: 0,03/16 = 0,001875 (mol) hay 0,09 (g).
Số mol oxi có trong bình: 0,02 - 0,001875 = 0,018125 (mol) hay 0,58 g.
Khối lượng của hỗn hợp: 0,09 + 0,58 = 0,67 (g).
Phẩn trăm khối lượng cua ozon trong hỗn hợp: 0,09 x 100/0,67 = 13,43%
14. Giải bài 29.14 trang 65 SBT Hóa học 10
Hỗn hợp khí ozon và oxi có tỉ khối so với khí H2 là 18.
a) Xác định % thể tích của ozon trong hỗn hợp.
b) Khi cho 1 lít (đktc) hỗn hợp khí đó đi qua bạc kim loại, khối lượng của bạc sẽ tăng lên bao nhiêu ?
Phương pháp giải
a) Gọi x là số mol O3 có trong 1 mol hỗn hợp khí, số mol O2 sẽ là (1 - x) mol.
Ta có phương trình : 48x + (1 - x).32 = 18.2
Giải ra x = 0,25.
b) 2Ag + O2 → Ag2O + O2 (1)
Theo (1) : 22,4 lít O3 tạo ra 1 mol Ag2O khối lượng tăng 16 g
0,25 lít O3 tạo ra 1 mol Ag2O khối lượng tăng x g.
\(x = \dfrac{{16.0,25}}{{22,4}} \)
Hướng dẫn giải
Gọi x là số mol O3 có trong 1 mol hỗn hợp khí, số mol O2 sẽ là (1 - x) mol.
Ta có phương trình : 48x + (1 - x).32 = 18.2
Giải ra x = 0,25.
Do %n = %V nên ozon chiếm 25% thể tích hỗn hợp.
b) 2Ag + O2 → Ag2O + O2 (1)
Theo (1): 22,4 lít O3 tạo ra 1 mol Ag2O khối lượng tăng 16 g
0,25 lít O3 tạo ra 1 mol Ag2O khối lượng tăng x g.
x = 16x0,25/22,4 = 0,178g
15. Giải bài 29.15 trang 66 SBT Hóa học 10
Có các chất khí không màu sau là: hiđro clorua, cacbonic, oxi, ozon.
Hãy nêu phương pháp hoá học để phân biệt các khí trên.
Phương pháp giải
Xem lại lý thuyết về oxi - ozon.
Hướng dẫn giải
+ Dùng giấy quỳ tím tẩm nước để nhận ra khí HCl.
+ Dùng nước vôi trong để nhận ra khí CO2.
+ Dùng dung dịch chứa hỗn hợp KI và hồ tinh bột để nhận ra ozon.
+ Khí còn lại là oxi.
16. Giải bài 29.16 trang 66 SBT Hóa học 10
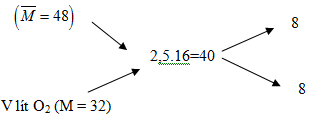
Hỗn hợp khí SO2 và O2 có tỉ khối hơi đối với metan (CH4) bằng 3. Tính thể tích khí O2 cần thêm vào 20 lít hỗn hợp trên để thu được hỗn hợp khí có tỉ khối hơi bằng 2,5.
Phương pháp giải
Hỗn hợp đầu có : V = 20 lít, M = 3.16 = 48
Áp dụng phương pháp đường chéo ta có
Hướng dẫn giải
Hỗn hợp đầu có : V = 20 lít, M = 3.16 = 48
Áp dụng phương pháp đường chéo ta có :

→ \(V_{O_2}\)=20 lít
