Giải bài tập SBT Hóa 10 Bài 26: Luyện tập: Nhóm halogen
Dưới đây là Hướng dẫn giải Hóa 10 SBT Chương 5 Bài 26 được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình Hóa học 10 giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung
1. Giải bài 26.1 trang 60 SBT Hóa học 10
2. Giải bài 26.2 trang 60 SBT Hóa học 10
3. Giải bài 26.3 trang 60 SBT Hóa học 10
4. Giải bài 26.4 trang 61 SBT Hóa học 10
5. Giải bài 26.5 trang 61 SBT Hóa học 10
6. Giải bài 26.6 trang 61 SBT Hóa học 10
7. Giải bài 26.7 trang 61 SBT Hóa học 10
8. Giải bài 26.8 trang 61 SBT Hóa học 10
9. Giải bài 26.9 trang 61 SBT Hóa học 10
10. Giải bài 26.10 trang 61 SBT Hóa học 10
11. Giải bài 26.11 trang 61 SBT Hóa học 10
12. Giải bài 26.12 trang 62 SBT Hóa học 10
13. Giải bài 26.13 trang 62 SBT Hóa học 10
14. Giải bài 26.14 trang 62 SBT Hóa học 10

1. Giải bài 26.1 trang 60 SBT Hóa học 10
Cho phản ứng: SO2 + Br2 + 2H2O → H2SO4 + 2X
X là chất nào sau đây ?
A. HBr
B. HBrO
C. HBrO3
D. HBrO4
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
Ta có:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
→ Đáp án A
2. Giải bài 26.2 trang 60 SBT Hóa học 10
Khi đổ dung dịch AgNO3 vào dung dịch chất nào sau đây sẽ thu được kết tủa màu vàng đậm nhất ?
A. Dung dịch HF
B. Dung dịch HCl
C. Dung dịch HBr
D. Dung dịch HI
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
Khi cho AgNO3 vào dung dịch HI thì thu được kết tủa màu vàng đậm.
→ Đáp án D
3. Giải bài 26.3 trang 60 SBT Hóa học 10
Brom bị lẫn tạp chất là clo, để thu được brom tinh khiết cần làm cách nào sau đây ?
A. Dẫn hỗn hợp đi qua dung dịch H2SO4 loãng
B. Dẫn hỗn hợp đi qua nước
C. Dẫn hỗn hợp đi qua dung dịch NaBr
D. Dẫn hỗn hợp đi qua dung dịch NaI
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
Dẫn hỗn hợp qua dung dịch NaBr sẽ thu được brom tinh khiết vì xảy ra phản ứng:
Cl2 + 2NaBr → 2NaCl + Br2
→ Chọn C
4. Giải bài 26.4 trang 61 SBT Hóa học 10
Dãy axit nào sau đây sắp xếp đúng theo thứ tự giảm dần tính axit ?
A. HI > HBr > HCL > HF
B. HF > HCl > HBr > HI
C. HCL > HBr > HI > HF
D. HCl > HBr > HF > HI
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
Dãy axit sắp xếp đúng theo thứ tự giảm dần tính axit là HI > HBr > HCl > HF
→ Đáp án A
5. Giải bài 26.5 trang 61 SBT Hóa học 10
Dãy ion nào sau đây sắp xếp đúng theo thứ tự giảm dần tính khử ?
A. F- > Cl- > Br- > I-
B. I- > Br- > Cl- > F-
C. Br- > I- > Cl- > F-
D. Cl- > F- > Br- > I-
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
Dãy ion sắp xếp đúng theo thứ tự giảm dần tính khử là I- > Br- > Cl- > F-
→ Đáp án B
6. Giải bài 26.6 trang 61 SBT Hóa học 10
Vì sao người ta có thể điều chế Cl2, Br2, I2 bằng cách cho hỗn hợp dung dịch H2SO4 đặc và MnO2 tác dụng với muối clorua, bromua, iotua nhưng không thể áp dụng phương pháp này để điều chế F2 Bằng cách nào có thể điều chế được F2 ? Viết PTHH của các phản ứng.
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
Người ta có thể điều chế Cl2, Br2, I2 bằng cách cho hỗn hợp dung dịch H2SO4 đặc và MnO2 tác dụng với muối clorua, bromua, iotua
Các sản phẩm trung gian là HCl, HBr, HI bị hỗn hợp (MnO2 + H2SO4) oxi hoá thành Cl2, Br2, I2. Các PTHH có thể viết như sau :
NaCl + H2SO4→ NaHSO4 + HCl
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Các phản ứng cũng xảy ra tương tự đối với muối NaBr và NaI.
Không thể áp dụng phương pháp trên để điều chế F2 vì hỗn hợp oxi hoá (MnO2 + H2SO4) không đủ mạnh để oxi hoá HF thành F2
Cách duy nhất điều chế F2 là điện phân KF tan trong HF lỏng khan Dùng dòng điện một chiểu 8-12 von; 4000 - 6000 ampe ; Bình điện phân có catôt làm bằng thép đặc biệt hoặc bằng đồng và anôt làm bằng than chì (graphit).
Ở catot: 2H+ + 2e → H2
Ở anot: 2F- → F2 + 2e
7. Giải bài 26.7 trang 61 SBT Hóa học 10
Bằng phương pháp hoá học nào có thể
a) Xác định được có khí clo lẫn trong khí hiđro clorua ?
b) Thu được khí clo từ hỗn hợp khí ở câu a ?
c) Thu được khí hiđro clorua từ hỗn hợp khí ở câu a ?
Viết PTHH của các phản ứng xảy ra.
Phương pháp giải
Xem lại lý thuyết về HCl
Hướng dẫn giải
a) Cho hỗn hợp khí đi qua dung dịch HBr hoặc dung dịch HI, Cl2 sẽ oxi hoá HBr hoặc HI thành Br2 hoặc I2 làm cho dung dịch không màu ban đầu chuyển thành màu vàng hoặc màu nâu.
Cl2 + 2HBr → 2HCl + Br2 (dung dịch có màu vàng)
hoặc Cl2 + 2HI → 2HCl + I2 (dung dịch có màu vàng nâu)
b) Cho hỗn hợp khí trên (HCl và Cl2) tác dụng với chất oxi hoá mạnh là MnO2 dung dịch KMnO4 bị oxi hoá thành Cl2, kết quả thu được chất khí duy nhất là Cl2
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
c) Cho hỗn hợp khí trên tác dụng với H4 ở nhiệt độ cao, thu được khí duy nhất là HCl
Cl2 + H2→ 2HCl
Hoặc cho hỗn hợp khí đi qua ống đựng bột đồng kim loại đun nóng, khí Cl2 tác dụng với đồng kim loại tạo muối clorua là chất rắn. Chất khí không tác dụng với đồng kim loại là HCl, nên chất khí đi ra chỉ là HCl.
Cu + Cl2 to→ CuCl2
8. Giải bài 26.8 trang 61 SBT Hóa học 10
Có 4 lọ không có nhãn đựng riêng biệt các muối: KF, KCl, KBr, KI.
Hãy cho biết:
a) Cách phân biệt muối đựng trong mỗi lọ bằng phương pháp hoá học.
b)Từ những muối đã cho điều chế các halogen tương ứng và các hiđro halogenua tương ứng.
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
a) Lấy một ít muối trong mỗi lọ đem hoà tan vào nước được các dung dịch riêng biệt.
Dung dịch nào tác dụng được với Br2 hoặc nước brom tạo ra tinh thể có màu đen tím, đó là dung dịch KI.
Br2 + 2KI → 2KBr + I2
Những dung dịch còn lại, dung dịch nào tác dụng được với Cl2 tạo ra dung dịch có màu vàng nâu (màu của Br2 tan trong nước), đó là dung dịch KBr.
Cl2 + 2KBr → 2KCl + Br2
Hai dung dịch còn lại là KF và KCl: cho tác dụng với dung dịch AgNO3, dung dịch nào tạo kết tủa trắng, đó là dung dịch KCl.
KCl + AgNO3 → AgCl + KNO3
Dung dịch còn lại là KF.
b) Điều chế halogen tương ứng từ muối đã cho :
Điều chế F2 : Điện phân mưối KF tan trong chất lỏng HF khan thu được F2 ở anôt.
Điều chế Cl2 : Điện phân dung dịch KCl trong nước, có màng ngăn.
Điều chế Br2: Cho H2SO4 đặc tác dụng với hỗn hợp rắn là KBr và MnO2 đun nóng. Các phản ứng xảy ra như sau:
2KBr + H2SO4 → K2SO4 + 2HBr (1)
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O (2)
MnBr2 + H2SO4 → MnSO4 + 2HBr (3)
Phản ứng tổng của (1), (2), (3) là :
2KBr + MnO2 + 2H2SO4 → K2SO4 + MnSO4 + Br2 + 2H2O (4)
Điều chế I2 tương tự điểu chế Br2 và có phản ứng tổng là :
2KI + MnO2 + 2H2SO4 → K2SO4 + MnSO4 + I2 + 2H2O (4)
- Điều chế các hiđro halogenua từ các muối tương ứng :
Điều chế HF: KF + H2SO4 → KHSO4 + HF
Điều chế HCl: KCl + H2SO4 → KHSO4 + HCl
Điều chế HBr: Điện phân dung dịch KBr có màng ngăn (hoặc cho Cl2 tác dụng với dung dịch KBr, hoặc cho muối KBr tác dụng với hỗn hợp MnO2 và H2SO4 đặc ) được Br2 sau đó cho Br2 ác dụng với H2 ở nhiệt độ cao được HBr.
H2 + Br2 → 2HBr
Điều chế HI: Tương tự như điều chế HBr ở trên hoặc từ I2 ta điều chế HI bằng cách dùng khí H2S và khử I2
I2 + H2S → 2HI+ S
9. Giải bài 26.9 trang 61 SBT Hóa học 10
Tính khối lượng muối NaCl và muối NaI cần thiết để có 10 tấn muối ăn chứa 2,5% NaI.
Phương pháp giải
\({m_{NaI}} = 10.\dfrac{{2,5}}{{100}}\)
\({m_{NaCl}} = 10 - {m_{NaI}}\)
Hướng dẫn giải
Một tấn muối ăn chứa 0,025 tấn NaI
→ Khối lượng NaI = 0,25 tấn
Khối lượng NaCl = 9,75 tấn.
Vậy khối lượng muối NaCl và muối NaI lần lượt là 0,25 tấn và 9,75 tấn.
10. Giải bài 26.10 trang 61 SBT Hóa học 10
Cho các chất sau: KCl, CaCl2, MnO2, dung dịch H2SO4 đặc. Đem trộn 2 hoặc 3 chất với nhau. Trộn như thế nào thì tạo thành clo ? Trộn như thế nào thì tạo thành hiđro clorua ? Viết PTHH của các phản ứng.
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
+ Để tạo thành clo thì trộn KCl hoặc CaCl2 với MnO2 và H2SO4 đặc
2KCl + H2SO4 (đặc) to→ K2SO4 + 2HCl
MnO2 + 4HCl to→ MnCl2 + Cl2 + 2H2O
+ Để tạo thành hiđro clorua thì trộn KCl hoặc CaClO với H2SO4 đặc
CaCl2 + 2H2SO4 to→ Ca(HSO4)2 + 2HCl
11. Giải bài 26.11 trang 61 SBT Hóa học 10
Dựa vào cấu tạo, hãy giải thích vì sao tính oxi hoá của ion hipoclorit HClO- mạnh hơn ion clorat HClO3- .. Lấy thí dụ phản ứng để minh hoạ.
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
ClO- và ClO3- có cấu tạo tương ứng như sau :
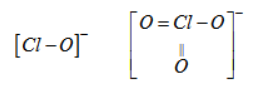
Liên kết Cl-O trong ClO3- ngắn hơn trong ClO- nên độ bền ClO3- > ClO-
Do đó tính oxi hoá ClO3- < ClO-
Trong dung dịch nước, ion ClO3- chỉ oxi hoá trong môi trường axit mạnh, còn ion ClO- oxi hoá trong bất kì môi trường nào.
NaClO + 2KI + H2O → NaCl + I2 + 2KOH
NaClO3 + 6KI + 3H2SO4 → NaCl + 3I2 + 3K2SO4 + 3H2O
12. Giải bài 26.12 trang 62 SBT Hóa học 10
Khi đun nóng muối kaliclorat, không có xúc tác, thì muối này bị phân huỷ đồng thời theo 2 phản ứng sau :
2KClO3 → 2KCl + 3O2 (a)
4KClO3 → 3KClO4 + KCl (b)
Cho biết khi phân huỷ hoàn toàn 73,5 gam KClO3 thì thu được 33,57 gam KCl. Hãy tính bao nhiêu % kali clorat bị phân huỷ theo (a) ; bao nhiêu % bị phân huỷ theo (b).
Phương pháp giải
Gọi x là số mol \(KClO_3\) bị phân huỷ theo (a).
Gọi y là số mol \(KClO_3\) bị phân huỷ theo (b).
Giải hệ phương trình:
\(\begin{array}{l}
x + y = \dfrac{{73,5}}{{122,5}} = 0,6\,\,\,\,(1)\\
x + \dfrac{y}{4} = \dfrac{{33,5}}{{74,5}} = 0,45\,\,\,\,\,(2)
\end{array}\)
Tính phần trăm \(KClO_3\) phân hủy theo (a) và (b)
Hướng dẫn giải
Gọi x là số mol KClO3 bị phân huỷ theo (a).
Gọi y là số mol KClO3 bị phân huỷ theo (b).
a) 2KClO3 → 2KCl + 3O2
4KClO3 → 3KClO4 + KCl
Ta có x + y = 73,5/122,5 = 0,6 (1)
x + y/4 = 33,5/74,5 = 0,45 (2)
Từ (1) và (2) , giải ra:
x =0,4 → phần trăm KClO3 bị phân hủy theo (a) là: 0,4/0,6 x 100 % = 66,66%
y =0,2 → phần trăm KClO3 bị phân hủy theo (b) là: 0,2/0,6 x 100 % = 33,34%
13. Giải bài 26.13 trang 62 SBT Hóa học 10
Iot có lẫn các tạp chất là clo, brom và nước. Để tinh chế loại iot đó, người ta cho hỗn hợp đó tác dụng với KI và vôi ống rồi nung hỗn hợp trong cốc được đậy bằng một bình có chứa nước lạnh. Khi đó iot sẽ bám vào đáy bình. Viết PTHH của các phản ứng xảy ra.
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
Cl2 + 2KI → 2KCl + I2
Br2 + 2KI → 2KBr + I2
Vôi sống tác dụng với H2O
CaO + H2O → Ca(OH)2
Iot thăng hoa bám vào đáy bình
14. Giải bài 26.14 trang 62 SBT Hóa học 10
Người ta có thể điều chế I2 bằng các cách sau :
a) Dùng NaHCO3 khử iot có số oxi hoá +5 trong hợp chất NaIO3
b) Cho dung dịch H2SO4 đặc tác dụng với hỗn hợp NaI và MnO2
Hãy lập PTHH của các phản ứng điều chế trên.
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
a) 2NaIO3 + 5NaHCO3 → 2Na2SO4 + 3NaHSO4 + I2 + H2O
b) 2NaI + MnO2 + 2H2SO4 → Na2SO4 + MnSO4 + I2 + 2H2O
15. Giải bài 26.15 trang 62 SBT Hóa học 10
Vì sao người ta có thể điều chế hiđro clorua (HCl), hiđro florua (HF) bằng cách cho dung dịch H2SO4 đặc tác dụng với muối clorua hoặc florua, nhưng không thể áp dụng phương pháp này để điều chế hiđro bromua (HBr) hoặc hiđro iotua (HI) ? Viết PTHH của các phản ứng điều chế các hiđro halogenua.
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
Điều chế HF, HCl bằng cách cho H2SO4 đặc tác dụng với muối florua, clorua vì H2SO4 là chất oxi hoá không đủ mạnh để oxi hoá được HF và HCl. Nói cách khác, HF và HCl có tính khử yếu, chúng không khử được H2SO4 đặc
CaF2 + H2SO4 → CaSO4 + 2HF
NaCl + H2SO4 → NaHSO4 + HCl
Nhưng không thể dùng phương pháp trên để điều chế HBr và HI vì H2SO4 đặc oxi hoá được những chất này thành Br2 và I2. Nói cách khác, HBr và HI là những chất có tính khử mạnh hơn HCl và HF.
NaBr + H2SO4 → HBr + NaHSO4
2HBr + H2SO4 → Br2 + SO2 + 2H2O
NaI + H2SO4 → NaHSO4 + HI
2HI + H2SO4 → I2 + SO2 + 2H2O
16. Giải bài 26.16 trang 62 SBT Hóa học 10
Có 4 bình không có nhãn, mỗi bình chứa một trong các dung dịch sau: NaCl, NaNO3, BaCl2, Ba(NO3)2. Trình bày phương pháp hoá học để phân biệt từng dung dịch chứa trong mỗi bình.
Phương pháp giải
Xem lại lý thuyết về nhóm halogen
Hướng dẫn giải
Thử bằng dung dịch AgNO3 nhận ra 2 muối clorua :
NaCl + AgNO3 → AgCl + NaNO3
BaCl2 + AgNO3 → AgCl + Ba(NO3)2
Hai dung dịch không có kết tủa là 2 muối nitrat.
Để phân biệt dung dịch NaCl và dung dịch BaCl2 thử bằng dung dịch H2SO4
BaCl2 + H2SO4 → BaSO4 + 2HCl
Cũng dùng dung dịch H2SO4 để phân biệt dung dịch NaNO3 và Ba(NO3)2
Tham khảo thêm
- doc Giải bài tập SBT Hóa 10 Bài 21: Khái quát về nhóm halogen
- doc Giải bài tập SBT Hóa 10 Bài 22: Clo
- doc Giải bài tập SBT Hóa 10 Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
- doc Giải bài tập SBT Hóa 10 Bài 24: Sơ lược về hợp chất có oxi của clo
- doc Giải bài tập SBT Hóa 10 Bài 25: Flo - Brom - Iot
