Giải bài tập SBT Hóa 10 Bài 13: Liên kết cộng hóa trị
Bài này sẽ giúp các em nắm vững cách giải các bài tập của bài Liên kết cộng hóa trị với cách làm đầy đủ, chi tiết và rõ ràng. Hy vọng đây sẽ là tài liệu tham khảo hữu ích cho các em học sinh
Mục lục nội dung
1. Giải bài 13.1 trang 32 SBT Hóa học 10
2. Giải bài 13.2 trang 32 SBT Hóa học 10
3. Giải bài 13.3 trang 32 SBT Hóa học 10
4. Giải bài 13.4 trang 32 SBT Hóa học 10
5. Giải bài 13.5 trang 32 SBT Hóa học 10
6. Giải bài 13.6 trang 33 SBT Hóa học 10
7. Giải bài 13.7 trang 33 SBT Hóa học 10
8. Giải bài 13.8 trang 33 SBT Hóa học 10
9. Giải bài 13.9 trang 33 SBT Hóa học 10
10. Giải bài 13.10 trang 33 SBT Hóa học 10
11. Giải bài 13.11 trang 33 SBT Hóa học 10
12. Giải bài 13.12 trang 33 SBT Hóa học 10
13. Giải bài 13.13 trang 33 SBT Hóa học 10
14. Giải bài 13.14 trang 34 SBT Hóa học 10
15. Giải bài 13.15 trang 34 SBT Hóa học 10
16. Giải bài 13.16 trang 34 SBT Hóa học 10
17. Giải bài 13.17 trang 34 SBT Hóa học 10
18. Giải bài 13.18 trang 34 SBT Hóa học 10
19. Giải bài 13.19 trang 34 SBT Hóa học 10
20. Giải bài 13.20 trang 34 SBT Hóa học 10
21. Giải bài 13.21 trang 34 SBT Hóa học 10

1. Giải bài 13.1 trang 32 SBT Hóa học 10
Hợp chất có liên kết cộng hoá trị là
A. NaF.
B. KBr.
C. CaF2
D. CCl4
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
NaF, KBr, CaF2 là các hợp chất ion chứa liên kết ion.
→ Chọn D
2. Giải bài 13.2 trang 32 SBT Hóa học 10
Hợp chất có liên kết ion là
A. H2O
B. NH3
C. CCl3
D. CsF
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
Liên kết ion hình thành giữa kim loại điển hình và phi kim điển hình (CsF)
→ Chọn D
3. Giải bài 13.3 trang 32 SBT Hóa học 10
Công thức nào sau đây là công thức cấu tạo đúng của hợp chất C3H6
A. CH2=CH-CH2
B. CH2=CH-CH3
C. CH2=CH=CH3
D. CH2-CH-CH3
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
Công thức cấu tạo của C3H6 là:
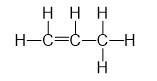
→ Chọn B
4. Giải bài 13.4 trang 32 SBT Hóa học 10
Công thức electron đúng của hợp chất PH3 là?
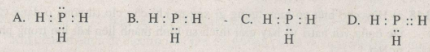
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
Công thức e của PH3 là:
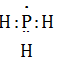
→ Chọn A
5. Giải bài 13.5 trang 32 SBT Hóa học 10
Cho độ âm điện của các nguyên tố: O = 3,44 ; G = 3,16 ; N = 3,04 ; C = 2,55 ; H = 2,20. Trong các hợp chất: H2O, NH3, HCl, CH4 Số hợp chất chứa liên kết cộng hoá trị có cực là
A. 1.
B. 2.
C. 3.
D. 4.
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị
Hướng dẫn giải
H2O có 0,4 < Δχ = 1,24 < 1,7 ⇒ liên kết cộng hóa trị có cực
NH3 có 0,4 < Δχ = 0,84 < 1,7 ⇒ liên kết cộng hóa trị có cực
HCl có 0,4 < Δχ = 0,96 < 1,7 ⇒ liên kết cộng hóa trị có cực
CH4 có Δχ = 0,35 < 0,4 ⇒ liên kết cộng hóa trị không cực
⇒ Chọn C
6. Giải bài 13.6 trang 33 SBT Hóa học 10
Dãy gồm các chất trong phân tử chỉ có liên kết cộng hóa trị phân cực là
A. O2, H2O, NH3
B. H2O, HF, H2S
C. HCl, O2, H2S
D. HF, Cl2, H2O
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị
Hướng dẫn giải
H2O, HF, H2S: là các chất có liên kết cộng hóa trị phân cực
→ Chọn B
7. Giải bài 13.7 trang 33 SBT Hóa học 10
Dãy gồm các chất mà phân tử không phân cực là
A. HBr, CO2, CH4.
B. NH3, Br2, C2H4
C. HCl, C2H2, Br2
D. Cl2, CO2, C2H2
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị
Hướng dẫn giải
Cl2, CO2, C2H2 là các chất có liên kết cộng hóa trị không phân cực
→ Chọn D
8. Giải bài 13.8 trang 33 SBT Hóa học 10
Cho các phân tử: HCl, HBr, HI, HF. Phân tử có liên kết phân cực mạnh nhất là:
A. HBr
B. HI
C. HCl
D. HF
Phương pháp giải
Chất có liên kết phân cực mạnh nhất thì \(\Delta \chi \) lớn nhất
Hướng dẫn giải
HF có: Δχ = 3,98 - 2,2 = 1,78
HCl có: Δχ = 3,16 - 2,2 = 0,96
HBr có: Δχ = 2,96 - 2,2 = 0,76
HCl có: Δχ = 2,66 - 2,2 = 0,46
Chất có liên kết phân cực mạnh nhất thì Δχ lớn nhất (HF)
⇒ Chọn D
9. Giải bài 13.9 trang 33 SBT Hóa học 10
Liên kết hóa học được hình thành do sự di chuyển những electron lớp ngoài cùng của nguyên tử để tạo thành cặp electron liên kết là kiểu
A. Liên kết ion
B. Liên kết cộng hóa trị
C. Liên kết kim loại
D. Liên kết hiđro
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
Liên kết hóa học được hình thành do sự di chuyển những electron trong lớp ngoài cùng của nguyên tử để tạo thành cặp electron liên kết là kiểu liên kết cộng hóa trị
⇒ Chọn B
10. Giải bài 13.10 trang 33 SBT Hóa học 10
Nguyên tố oxi có cấu hình electron là 1s22s22p4. Sau liên kết, nó có cấu hình electron là
A. 1s22s22p42p2
B. 1s22s22p43s2
C. 1s22s22p6
D. 1s22s22p63s2
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
Sau khi hình thành liên kết oxi có cấu hình e của khí hiếm gần nhất: 1s22s22p6
⇒ Chọn C
11. Giải bài 13.11 trang 33 SBT Hóa học 10
Cấu hình electron nào sau đây bền nhất?
A. 1s22s22p2
B. 1s22s23s2
C. 1s22s22p3
D. 1s22s22p6
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
Khí hiếm có cấu hình e bền nhất (đủ 8e ở lớp ngoài cùng): 1s22s22p6
⇒ Chọn D
12. Giải bài 13.12 trang 33 SBT Hóa học 10
a) Hãy giải thích sự liên kết giữa hai nguyên tử H tạo thành phân tử H2, giữa hai nguyên tử Cl tạo thành phân tử Cl2
b) Thế nào là liên kết cộng hoá trị ?
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
a) Nguyên tử H, với cấu hình electron là 1s1, có 1 electron hoá trị. Trong phân tử H2, hai nguyên tử H liên kết với nhau bằng cách mỗi nguyên tử H góp 1 electron tạo thành một cặp electron chung :
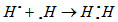
Như vậy, trong phân tử H2, mỗi nguyên tử có 2 electron giống lớp vỏ bền vững của khí hiếm heli (He).
Nguyên tử clo (Cl) có 7 electron hoá trị. Một cách tương tự, trong phân tử Cl2, mỗi nguyên tử Cl đạt được cấu hình 8 electron ở lớp ngoài cùng giống nguyên tử khí hiếm Ar khi mỗi nguyên tử góp 1 electron tạo thành cặp electron chung :
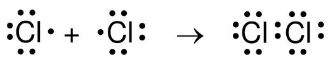
Liên kết giữa hai nguyên tử H hay giữa hai nguyên tử Cl được gọi là liên kết cộng hoá trị.
Liên kết cộng hoá trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
13. Giải bài 13.13 trang 33 SBT Hóa học 10
a) Hãy biểu diễn các liên kết trong các phân tử H2, Cl2, N2 bằng công thức electron và bằng công thức cấu tạo.
b) Hãy cho biết thế nào là liên kết đơn, thế nào là liên kết ba, cho thí dụ.
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
Phân tử H2
+ Công thức electron H:H
+ Công thức cấu tạo H-H
Phân tử Cl2
+ Công thức electron 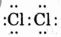
+ Công thức cấu tạo Cl - Cl
Phân tử N2
+ Công thức electron 
+ Công thức cấu tạo N≡N
b) Mỗi cặp electron chung được biểu thị bằng một gạch nối và được coi là một liên kết.
Nếu giữa hai nguyên tử có một liên kết thì liên kết đó được gọi là liên kết đơn, thí dụ H - H ; Cl - Cl.
Nếu giữa hai nguyên tử có ba liên kết thì liên kết đó được gọi là liên kết ba, thí dụ N≡N
14. Giải bài 13.14 trang 34 SBT Hóa học 10
a) Thế nào là liên kết cộng hoá trị không phân cực (không cực) ?
b) Thế nào là liên kết cộng hoá trị phân cực (có cực) ? Mỗi trường hợp hãy cho hai thí dụ và biểu diễn các liên kết bằng công thức electron.
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
a) Liên kết cộng hoá trị không phân cực là liên kết cộng hoá trị giữa hai nguyên tử có hiệu độ âm điện nhỏ hơn 0,4. Các cặp electron chung phân bố đồng đều giữa hai nguyên tử.
Thí dụ: H2 ; Cl2
H : H ; Cl : Cl
b) Liên kết cộng hoá trị phân cực (có cực) là liên kết giữa hai nguyên tử khác nhau có hiệu độ âm điện từ 0,4 đến 1,7 ; các cặp electron phân bổ lệch về phía nguyên tử có độ âm điện lớn.
Thí dụ: HCl ; HF
H :Cl ; H :F
15. Giải bài 13.15 trang 34 SBT Hóa học 10
Hãy giải thích sự hình thành phân tử khí cacbonic CO2
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
Nguyên tử cacbon (C) có 4 electron hoá trị, nguyên tử oxi (O) có 6 electron hoá trị.
Trong phân tử (CO2), nguyên tử C ở giữa hai nguyên tử O. Nguyên tử C góp chung với mỗi nguyên tử O hai electron, mỗi nguyên tử O góp chung với nguyên tử C hai electron tạo ra hai liên kết đôi:
Công thức electron: 
Công thức cấu tạo: O=C=O
Như vậy, theo công thức electron, nguyên tử C cũng như mỗi nguyên tử O đều được bao quanh bởi 8 electron lớp ngoài cùng, đạt cấu hình vững bền của khí hiếm (Ne).
16. Giải bài 13.16 trang 34 SBT Hóa học 10
Hãy viết công thức electron và công thức cấu tạo-của các phân tử H2O, NH3 (không cần chú ý đến cấu trúc không gian).
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị
Hướng dẫn giải
Phân tử H2O
+ Công thức electron 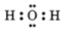
+ Công thức cấu tạo H - O - H
Phân tử NH3
+ Công thức electron 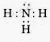
+ Công thức cấu tạo 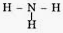
17. Giải bài 13.17 trang 34 SBT Hóa học 10
Hãy cho biết tính chất chung của các chất có liên kết cộng hoá trị.
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị
Hướng dẫn giải
Liên kết cộng hoá trị là liên kết giữa các nguyên tử trong cùng một phân tử (liên kết định hướng). Như vậy, mỗi phân tử có thể được coi là một đơn vị độc lập nên so với các hợp chất ion, các hợp chất liên kết cộng hoá trị có nhiệt độ nóng chảy, nhiệt độ hoá hơi thấp.
Ở điều kiện thường, hiđro, oxi, clo, khí cacbonic ở trạng thái khí ; nước, etanol (rượu etylic) ở trạng thái lỏng ; băng phiến, iot, đường ở trạng thái rắn. Các chất có cực như etanol, đường…. dễ tan trong dung môi nước (có cực) ; các chất không cực như propan, hexan,... dễ tan trong các dung môi không cực như benzen, cacbon tetraclorua,...
Nói chung, các chất chỉ có liên kết cộng hoá trị không cực không dẫn điện ở mọi trạng thái.
18. Giải bài 13.18 trang 34 SBT Hóa học 10
Hãy cho biết quan hệ giữa độ âm điện và sự hình thành liên kết ion, liên kết cộng hoá trị.
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị
Hướng dẫn giải
Ta đã biết kim loại và phi kim có độ âm điện rất khác nhau, chúng dễ tương tác với nhau tạo thành các hợp chất ion, thí dụ NaCl, CaF2, KBr,... Trong khi đó, giữa các phi kim, hiệu độ âm điện không lớn nên chúng dễ tương tác với nhau tạo thành các hợp chất có liên kết cộng hoá trị, thí dụ: Cl2, NO, ...
19. Giải bài 13.19 trang 34 SBT Hóa học 10
Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: Br2, CH4, H2O, NH3, C2H6
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
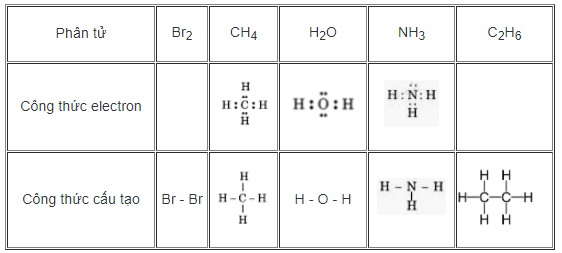
20. Giải bài 13.20 trang 34 SBT Hóa học 10
Các nguyên tố thuộc nhóm VIIA gồm những nguyên tố nào ?
Nguyên tử của các nguyên tố thuộc nhóm này có bao nhiêu electron hoá trị ?
Khi hai nguyên tử của cùng một nguyên tố thuộc nhóm này liên kết với nhau tạo thành phân tử thì mỗi nguyên tử phải góp bao nhiêu electron, tạo thành mấy liên kết, tại sao ? Cho thí dụ.
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
Các nguyên tố thuộc nhóm VIIA gồm các nguyên tố : flo (F), clo (Cl), brom (Br), iot (I), atatin (At). Nguyên tử của chúng có 7 electron hoá trị.
Khi hai nguyên tử của cùng một nguyên tố thuộc nhóm này liên kết với nhau tạo thành phân tử thì mỗi nguyên tử góp 1 electron, tạo thành một cặp electron chung tức là một liên kết, vì mỗi nguyên tử chỉ thiếu electron để đạt được cấu hình 8 electron vững bền (giống như của khí hiếm đứng sau nó).
21. Giải bài 13.21 trang 34 SBT Hóa học 10
Hãy viết công thức cấu tạo của các hợp chất: CH4, CO2, C2H6, C2H2, C2H4
Trong các hợp chất trên, cacbon có thể tham gia mấy liên kết cộng hoá trị ? Tại sao ?
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
CH4: 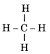
CO2: O = C = O
C2H6: 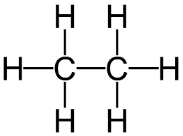
C2H2: H - C ≡ C - H
C2H4: 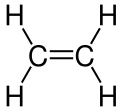
Trong các hợp chất trên, cacbon có thể tham gia 4 liên kết cộng hoá trị vì cacbon có 4 electron hoá trị, có thể góp 4 electron đó tạo thành 4 cặp electron chung.
22. Giải bài 13.22 trang 34 SBT Hóa học 10
Hãy viết công thức cấu tạo của các chất: H2, HCl, HBr, NH3
Trong các chất trên, hiđro có thể tham gia mấy liên kết cộng hoá trị? Tại sao ?
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
H - H; H - Cl; H - Br; .png)
Hiđro có thể tham gia một liên kết cộng hoá trị, vì nguyên tử H chỉ có electron duy nhất.
23. Giải bài 13.23 trang 34 SBT Hóa học 10
Trong số các chất sau đây :
Cl2, CaO, CsF,H2O, HCl, chất nào có liên kết ion, chất nào có liên kết cộng hoá trị ?
Phương pháp giải
Xem lại lý thuyết liên kết cộng hóa trị.
Hướng dẫn giải
Chất có liên kết ion: CaO, CsF.
Chất có liên kết cộng hoá trị: Cl2,H2O, HCl
