Giải bài tập SBT Hóa 10 Bài 24: Sơ lược về hợp chất có oxi của clo
Dưới đây là Hướng dẫn giải Hóa 10 SBT Chương 4 Bài 24 được eLib biên soạn và tổng hợp, nội dung bám sát theo chương trình Hóa học 10 giúp các em học sinh nắm vững phương pháp giải bài tập và ôn tập kiến thức hiệu quả hơn.
Mục lục nội dung
1. Giải bài 24.1 trang 56 SBT Hóa học 10
2. Giải bài 24.2 trang 57 SBT Hóa học 10
3. Giải bài 24.3 trang 57 SBT Hóa học 10
4. Giải bài 24.4 trang 57 SBT Hóa học 10
5. Giải bài 24.5 trang 57 SBT Hóa học 10
6. Giải bài 24.6 trang 57 SBT Hóa học 10
7. Giải bài 24.7 trang 57 SBT Hóa học 10
8. Giải bài 24.8 trang 58 SBT Hóa học 10

1. Giải bài 24.1 trang 56 SBT Hóa học 10
Nước Gia-ven là hỗn hợp các chất nào sau đây ?
A. HCl, HClO, H2O
B. NaCl, NaClO, H2O
C. NaCl, NaClO3, H2O
D. NaCl, NaClO4, H2O
Phương pháp giải
Xem lại lý thuyết về hợp chất có oxi của clo
Hướng dẫn giải
Nước Gia-ven là hỗn hợp NaCl, NaClO và H2O
→ Đáp án B
2. Giải bài 24.2 trang 57 SBT Hóa học 10
Tính chất sát trùng và tẩy màu của nước Gia-ven là do nguyên nhân nào sau đây ?
A. Do chất NaClO phân huỷ ra oxi nguyên tử có tính oxi hoá mạnh.
B. Do chất NaClO phân huỷ ra Cl2 là chất oxi hoá mạnh.
C. Do trong chất NaClO, nguyên tử Cl có số oxi hoá là +1, thể hiện tính oxi hoá mạnh.
D. Do chất NaCl trong nước Gia-ven có tính tẩy màu và sát trùng.
Phương pháp giải
Xem lại lý thuyết về hợp chất có oxi của clo.
Hướng dẫn giải
Tính chất sát trùng và tẩy màu của nước Gia-ven là do trong chất NaClO, nguyên tử Cl có số oxi hoá là +1, thể hiện tính oxi hoá mạnh.
Đáp án C
3. Giải bài 24.3 trang 57 SBT Hóa học 10
Hãy chọn nửa sơ đồ phản ứng ở cột II để ghép với nửa sơ đồ phản ứng II cột I cho phù hợp.
Cột I:
a) Cl2 + H2O →
b) Cl2 + NaOH (dd) →
c) Cl2 + NaOH (dd) to→
d) KClO3 MnO2→
e) KClO3 to→
Cột II:
1) KCl + O2
2) NaCl + NaClO3 + H2O
3) NaCl + NaClO + H2O
4) HCl + HClO
5) KClO4 + KCl
6) HCl + H2O
7) K + Cl2 + O2
Phương pháp giải
Xem lại lý thuyết về hợp chất có oxi của clo.
Hướng dẫn giải
a) Cl2 + H2O → HCl + HClO
b) Cl2 + NaOH (dd) → NaCl + NaClO + H2O
c) 3Cl2 + 6NaOH (dd) to→ 5NaCl + NaClO3 + 3H2O
d) 2KClO3 MnO2→ 2KCl + 3O2
e) 4KClO3 to→ 3KClO4 + KCl
Suy ra: a - 4 ; b- 3 ; c - 2; d-1; e- 5
4. Giải bài 24.4 trang 57 SBT Hóa học 10
Số oxi hóa của clo trong HClO4 là
A. +3
B. +5
C. +7
D. -1
Phương pháp giải
Gọi số oxi hóa của Cl trong HClO4 là x
Ta có: +1 + x + 4.(-2) = 0
Hướng dẫn giải
Gọi số oxi hóa của Cl trong HClO4 là x
Ta có: +1 + x + 4.(-2) = 0 → x = +7
→ Chọn C.
5. Giải bài 24.5 trang 57 SBT Hóa học 10
Viết PTHH của các phản ứng trong sơ đồ biến đổi sau (ghi đầy đủ điều kiện phản ứng):
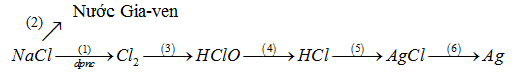
Phương pháp giải
Xem lại lý thuyết về hợp chất có oxi của clo
Hướng dẫn giải
1) 2NaCl (đpnc) → 2Na + Cl2
2) Cl2 + 2NaOH → NaCl + NaClO + H2O
3) Cl2 + H2O ⇔ HCl + HClO
4) 2HClO (ánh sáng) → 2HCl + O2
5) HCl + AgNO3 → AgCl + HNO3
6) 2AgCl (ánh sáng) → 2Ag + Cl2
6. Giải bài 24.6 trang 57 SBT Hóa học 10
Viết PTHH của các phản ứng xảy ra trong quá trình sản xuất clorua vôi từ đá vôi và muối ăn.
Phương pháp giải
Xem lại lý thuyết về hợp chất có oxi của clo
Hướng dẫn giải
CaCO3 → CaO + CO2 (đk: 900oC)
CaO + H2O → Ca(OH)2
2NaCl + 2H2O (đpdd có mn) → H2 + Cl2 + 2NaOH
Cl2 + Ca(OH)2 → CaOCl2 + H2O
7. Giải bài 24.7 trang 57 SBT Hóa học 10
Tại sao có thể dùng bình thép đựng khí clo khô mà không được dùng bình thép đựng khí clo ẩm ?
Phương pháp giải
Xem lại lý thuyết về hợp chất có oxi của clo
Hướng dẫn giải
Ở điều kiện thường, khí clo khô không tác dụng với sắt. Nếu có nước, clo tác dụng với nước tạo ra axit ăn mòn bình thép.
Dùng bình thép khô chứa Cl2 vì
Fe + Cl2 khô → không phản ứng ở nhiệt độ thường
Không được dùng bình thép ẩm chứa khí Cl2
Cl2 + H2O → HCl + HClO
8. Giải bài 24.8 trang 58 SBT Hóa học 10
Đưa một bình cầu đựng 250 gam nước clo ra ngoài ánh sáng mặt trời thì có 0,112 lít (đktc) khí được giải phóng. Hỏi khí nào được giải phóng? Tính nồng độ % của clo trong dung dịch đầu, cho rằng tất cả clo tan trong nước, đã phản ứng với nước.
Phương pháp giải
Khí được giải phóng là O2. Tính toán theo PTHH
Cl2 + H2O → HCl + HClO (1)
0,01 mol 0,01 mol
2HClO (ánh sáng) → 2HCl + O2 (2)
0,01 0,005
Hướng dẫn giải
Khi được giải phóng là O2 vì
Cl2 + H2O → HCl + HClO (1)
0,01 mol 0,01 mol
2HClO (ánh sáng) → 2HCl + O2 (2)
0,01 0,005
Từ (1) và (2) suy ra:
nCl2 = 0,01 mol
C%(clo) = 71.0,01/250 x 100% = 0,284%
9. Giải bài 24.9 trang 58 SBT Hóa học 10
Cho 17,4 gam MnO2 tác dụng hết với dung dịch HCl. Toàn bộ khí cu sinh ra được hấp thụ hết vào 145,8 gam dung dịch NaOH 20% ở nhiệt độ thường tạo ra dung dịch A. Hỏi dung dịch A có chứa những chất tan nào ? Tính nồng độ % của từng chất tan đó.
Phương pháp giải
Cl2 + 2NaOH → NaCl + NaClO + H2O
Trước pứ: 0,2 0,729
Trong pứ : 0,2 0,4 0,2 0,2 (mol)
Sau pứ: 0 0,329 0,2 0,2 (mol)
→ Dung dịch sau phản ứng gồm NaOH dư, NaCl, NaClO.
Hướng dẫn giải
MnO2 + HCl → MnCl2 + Cl2 + 2H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
\({n_{C{l_2}}} = {n_{Mn{O_2}}} = \dfrac{{17,4}}{{87}} = 0,2\,mol\)
\(C{\% _{NaOH}} = \dfrac{{{m_{ct}}}}{{{m_{dd}}}} \times 100\% \Rightarrow {m_{NaOH}} = \dfrac{{C\% .{m_{{\text{dd}}}}}}{{100\% }} = \dfrac{{20.145,8}}{{100}} = 29,16\left( g \right)\)
\( \Rightarrow {n_{NaOH}} = \dfrac{{{m_{NaOH}}}}{{{M_{NaOH}}}} = \dfrac{{29,16}}{{40}} = 0,729\left( {mol} \right)\)
Cl2 + 2NaOH → NaCl + NaClO + H2O
Trước pứ: 0,2 0,729
Trong pứ : 0,2 0,4 0,2 0,2 (mol)
Sau pứ: 0 0,329 0,2 0,2 (mol)
Số mol các chất sau phản ứng
\(n_{NaOH}\) = 0,329 mol → \(m_{NaOH}\) = 13,16 g
\(n_{NaCl}\) = 0,2 mol → \(m_{NaCl}\) = 11,7 g
\(n_{NaClO}\)= 0,2 mol → \(m_{NaClO}\) = 14,9 g
Vậy chứa các chất sau NaOH dư , NaCl , NaClO
\({m_{C{l_2}}} = 71.0,2 = 14,2\left( g \right) \Rightarrow {m_{{\text{dd}}saupu}} = {m_{C{l_2}}} + {m_{{\text{dd}}NaOH}} = 14,2 + 145,8 = 160\left( g \right)\)
C% NaOH = mct / mdd x 100% = 13,16 / 160 x 100% = 8,23 %
C% NaCl = mct / mdd x 100% = 11,7 / 160 x 100% = 7,31 %
C% NaClO = mct / mdd x 100% = 14,9 / 160 x 100% = 9,31 %
10. Giải bài 24.10 trang 58 SBT Hóa học 10
Trong phòng thí nghiệm có các hoá chất : NaCl, KMnO4, NaOH, H2O, dung dịch H2SO4 đặc. Viết PTHH của các phản ứng dùng để điều chế nước Gia-ven từ các chất trên.
Phương pháp giải
Xem lại lý thuyết về hợp chất có oxi của clo
Hướng dẫn giải
NaCl + H2SO4 → NaHSO4 + HCl
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Cl2 + 2NaOH (dư) → NaCl + NaClO + H2O
Tham khảo thêm
- doc Giải bài tập SBT Hóa 10 Bài 21: Khái quát về nhóm halogen
- doc Giải bài tập SBT Hóa 10 Bài 22: Clo
- doc Giải bài tập SBT Hóa 10 Bài 23: Hiđro clorua - Axit clohiđric và muối clorua
- doc Giải bài tập SBT Hóa 10 Bài 25: Flo - Brom - Iot
- doc Giải bài tập SBT Hóa 10 Bài 26: Luyện tập: Nhóm halogen
