Giải bài tập SBT Hóa 10 Bài 15: Hóa trị và số oxi hóa
Mời các em học sinh cùng tham khảo nội dung giải bài 15 SBT Hóa học 10 dưới đây. Tài liệu được biên soạn và tổng hợp với nội dung đầy đủ, chi tiết, hy vọng đây sẽ là tài liệu hữu ích giúp các em học tập thật tốt.
Mục lục nội dung
1. Giải bài 15.1 trang 35 SBT Hóa học 10
2. Giải bài 15.2 trang 35 SBT Hóa học 10
3. Giải bài 15.3 trang 35 SBT Hóa học 10
4. Giải bài 15.4 trang 36 SBT Hóa học 10
5. Giải bài 15.5 trang 36 SBT Hóa học 10
6. Giải bài 15.6 trang 36 SBT Hóa học 10
7. Giải bài 15.7 trang 36 SBT Hóa học 10
8. Giải bài 15.8 trang 36 SBT Hóa học 10
9. Giải bài 15.9 trang 36 SBT Hóa học 10
10. Giải bài 15.10 trang 36 SBT Hóa học 10
11. Giải bài 15.11 trang 37 SBT Hóa học 10
12. Giải bài 15.12 trang 37 SBT Hóa học 10
13. Giải bài 15.13 trang 37 SBT Hóa học 10
14. Giải bài 15.14 trang 37 SBT Hóa học 10

1. Giải bài 15.1 trang 35 SBT Hóa học 10
Số oxi hoá của mangan (Mn) trong hợp chất KMnO4 là
A. +1.
B. -1.
C. -5.
D. +7.
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
Số oxi hóa của Mn là: x = (-2).4 + 1 = +7
→ Chọn D
2. Giải bài 15.2 trang 35 SBT Hóa học 10
Những nguyên tố có cùng hoá trị trong các hợp chất với hiđro là
A. N, P, S.
B. P, As, Sb.
C. S, Te, Cl.
D. F, Cl, P.
Phương pháp giải
Viết CTCT của các hợp chất với H
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
Ta có CTCT của các hợp chất với H là:
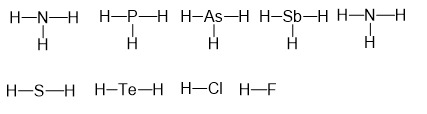
⇒ P, As, Sb có cùng hóa trị trong hợp chất với H
⇒ Chọn B
3. Giải bài 15.3 trang 35 SBT Hóa học 10
Điện hoá trị của các nguyên tố nhóm VIA, VIIA trong các hợp chất với các nguyên tố nhóm IA lần lượt bằng
A. 2,3.
B. 2, 1
C.1,2.
D. 1,3.
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
Công thức của nguyên tố nhóm VIA (A), VIIA (B) với nguyên tố nhóm IA (R) là: R2A, RB
Nguyên tố nhóm IA có điện hóa trị bằng 1+ nên điện hóa trị của nguyên tố nhóm VIA là 2-, điện hóa trị nguyên tố nhóm VIIA là 1-
⇒ Chọn B
4. Giải bài 15.4 trang 36 SBT Hóa học 10
Cộng hoá trị của N là 3, để đạt được cấu hình của khí hiếm thì N phải có
A. 3 liên kết ion.
B. 5 liên kết cộng hoá trị.
C.3 liên kết cộng hoá trị.
D. 5 liên kết ion.
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
Cộng hóa trị của nguyên tố bằng số liên kết của nguyên tố đó trong hợp chất cộng hóa trị.
N có cấu hình e: 1s22s22p3 thiếu 3e để đạt cấu hình e khí hiếm ⇒ cần 3 liên kết ⇒ cộng hóa trị 3
⇒ Chọn C
5. Giải bài 15.5 trang 36 SBT Hóa học 10
Nguyên tử A có Z = 15. Trong hợp chất với hiđro, nguyên tử này có khả năng tạo số liên kết cộng hoá trị là
A. 2 liên kết.
B. 3 liên kết.
C. 1 liên kết.
D. 5 liên kết.
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
Cộng hóa trị của nguyên tố bằng số liên kết của nguyên tố đó trong hợp chất cộng hóa trị.
Z = 15: 1s22s22p63s23p3 thiếu 3e để đạt cấu hình e khí hiếm ⇒ cần 3 liên kết trong hợp chất với H
⇒ Chọn B
6. Giải bài 15.6 trang 36 SBT Hóa học 10
Số oxi hoá của nitơ trong NH3, HNO2 và NO3- lần lượt là
A. +5,-3,+3.
B. -3,+3,+5.
C. +3,-3,+5.
D. +3,+5,-3.
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
Số oxi hóa của N lần lượt là: -3,+3,+5
⇒ Chọn B
7. Giải bài 15.7 trang 36 SBT Hóa học 10
Số oxi hoá của lưu huỳnh trong dãy H2S, H2SO3, H2SO4 lần lượt là
A. - 2, +4, +4.
B. -2, +3, +6.
C. -2, +4, +6.
D. -2, +3, +4.
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa
Hướng dẫn giải
8. Giải bài 15.8 trang 36 SBT Hóa học 10
Trong dãy hợp chất của sắt FeO, Fe2O3, Fe3O4, FexOy, FeS, FeS2 số oxi hoá của sắt lần lượt là
A. +2, +3, +4, \( + \frac{y}{{2x}}\) , +2, 0
B. +2, +3, \( + \frac{7}{3}\) , \( + \frac{{2x}}{y}\) , +2, +1
C. +2, +3, +3, \( + \frac{{2y}}{x}\) , +2, +1
D. +2, +3, \( + \frac{8}{3}\) , \( + \frac{{2y}}{x}\) ,+2,+2
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
Số oxi hóa của Fe lần lượt là: +2, +3, \( + \frac{8}{3}\) , \( + \frac{{2y}}{x}\) ,+2,+2
⇒ Chọn D
9. Giải bài 15.9 trang 36 SBT Hóa học 10
a) Hoá trị của một nguyên tố trong các hợp chất ion được gọi là gì ?
b) Hãy so sánh hoá trị của các kim loại trong các hợp chất: NaCl, CaF2
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
a) Hoá trị của một nguyên tố trong các hợp chất ion được gọi là điện hoá trị của nguyên tố đó
b) Trong các hợp chất NaCl và CaF2, canxi (Ca) có điện hoá trị lớn hơn điện hoá trị của natri (Na).
10. Giải bài 15.10 trang 36 SBT Hóa học 10
a) Hoá trị của một nguyên tố trong các hợp chất cộng hoá trị được gọi là gì ?
b) Hãy so sánh hoá trị của oxi (O) và của nitơ (N) trong các hợp chất: H2O; NH3
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
a) Hoá trị của một nguyên tố trong các hợp chất cộng hoá trị được gọi là cộng hoá trị của nguyên tố đó.
b) Trong các hợp chất H2O; NH3, nitơ có cộng hoá trị lớn hơn cộng hoá trị của oxi
11. Giải bài 15.11 trang 37 SBT Hóa học 10
a) Hãy cho biết quan hệ giữa số liên kết cộng hoá trị của một nguyên tử trong phân tử và cộng hoá trị của nguyên tố tương ứng.
b) Hãy viết công thức cấu tạo của NH3 và cho biết cộng hoá trị của nitơ trong hợp chất đó.
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
a) Trong các hợp chất cộng hoá trị thì cộng hoá trị của một nguyên tố được xác định bằng số liên kết cộng hoá trị của nguyên tử tương ứng trong phân tử.
b) .png)
Trong phân tử NH3, nguyên tử N tham gia 3 liên kết cộng hoá trị, vậy nitơ có cộng hoá trị 3.
12. Giải bài 15.12 trang 37 SBT Hóa học 10
Hãy viết công thức cấu tạo của các hợp chất: CO2, C2H6, C3H8, HCHO.
Hãy cho biết cộng hoá trị của cacbon trong các hợp chất đó.
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
CO2: O = C = O
C2H6: .png)
C3H8: 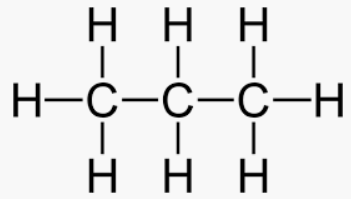
HCHO: 
13. Giải bài 15.13 trang 37 SBT Hóa học 10
a) Hãy cho biết số oxi hoá của các nguyên tố : H, N, O, Na, Ca trong các đơn chất H2, N2, O2, Na, Ca.
b) Hãy cho biết tổng số số oxi hoá của các nguyên tử oxi và hiđro trong phân tử H2O.
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
a) Số oxi hoá của các nguyên tố H, N, O, Na, Ca trong các đơn chất H2, N2, O2, Na, Ca đều bằng không.
b) Tổng số oxi hoá của hiđro và của oxi trong phân tử H2O bằng không: 2 × (+1) + (-2) = 0.
14. Giải bài 15.14 trang 37 SBT Hóa học 10
Hãy cho biết số oxi hoá của hiđro trong các hợp chất sau đây: HCl, HF, H2O, CH4, NaH, KH, MgH2, CaH2, CsH.
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
Hiđro có số oxi hoá :
- bằng +1 trong các hợp chất HCl, HF, H2O, CH4
- bằng -1 trong các hợp chất NaH, KH, MgH2, CaH2, CsH
15. Giải bài 15.15 trang 37 SBT Hóa học 10
Hãy cho biết số oxi hoá của clo trong các chất sau: HCl, Cl2, Cl2O, Cl2O3, Cl2O5, Cl2O7
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
Số oxi hoá của Cl trong các chất: HCl, Cl2, Cl2O, Cl2O3, Cl2O5, Cl2O7
Lần lượt là: -1,0,+1,+3,+5,+7
16. Giải bài 15.16 trang 37 SBT Hóa học 10
Hãy cho biết cộng hoá trị và số oxi hoá của cacbon trong các hợp chất sau đây: CH4, C2H6, C2H4, C2H2, HCHO, HCOOH
Phương pháp giải
Xem lại lý thuyết hóa trị và số oxi hóa.
Hướng dẫn giải
Trong các hợp chất đã cho, cacbon đều có cộng hoá trị là 4 nhưng số oxi hoá của cacbon trong các hợp chất:
CH4, C2H6, C2H4, C2H2, HCHO, HCOOH lần lượt là : -4, -3, -2, -1, 0, +2.
