Giải bài tập SBT Hóa 11 Bài 13: Luyện tập
Nhằm mục đích kiểm tra kiến thức về Tính chất của nitơ và hợp chất của nitơ cũng như cách vận dụng tích chất để giải bài tập. eLib xin giới thiệu đến các em học sinh nội dung giải bài tập SBT dưới đây. Với các bài tập có phương pháp và lời giải chi tiết, hi vọng rằng đây sẽ là tài liệu giúp các bạn học tập tốt hơn.
Mục lục nội dung

1. Giải bài 2.46 trang 19 SBT Hóa học 11
Viết các phương trình hóa học thực hiện các dãy chuyển hóa sau:
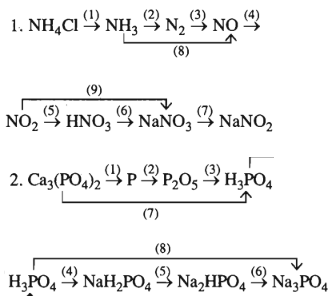
Phương pháp giải
Dựa vào tính chất hóa học của nito và các hợp chất của nito đề viết các phương trình hóa học của phản ứng
Hướng dẫn giải
1. Phương trình hóa học
(1) NH4Cl + NaOH → NH3 + H2O + NaCl
(2) 4NH3 + 3O2 → 2N2 + 6H2O
(3) N2 + O2 ⇔ 2NO
(4) 2NO + O2 → 2NO2
(5) 4NO2 + O2 + 2H2O → 4HNO3
(6) HNO3 + NaOH → NaNO3 + H2O
(7) 2NaNO3 → 2NaNO2 + O2
(8) 4NH3 + 5O2 → 4NO + 6H2O (đk: 850 - 900oC)
(9) 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
2. Phương trình hóa học
(1) Ca3(PO4)2 + 3SiO2 + 5C (1200oC)→ 2P + 3CaSiO3 + 5CO
(2) 4P + 5O2 to→ 2P2O5
(3) P2O5 + 3H2O → 2H3PO4
(4) H3PO4 + NaOH → NaH2PO4 + H2O
(5) NaH2PO4 + NaOH → Na2HPO4 + H2O
(6) Na2HPO4 + NaOH → Na3PO4 + H2O
(7) Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4
(8) H3PO4 + 3NaOH → Na3PO4 + 3H2O
2. Giải bài 2.47 trang 19 SBT Hóa học 11
Khí nitơ có thể được tạo thành trong các phản ứng hoá học nào sau đây ?
A. Đốt cháy NH3 trong oxi có mặt chất xúc tác platin
B. Nhiệt phân NH4NO3
C. Nhiệt phân AgNO3
D. Nhiệt phân NH4NO2
Phương pháp giải
- Viết tất cả các PTHH của 4 phản ứng trên từ đó xác định phản ứng tạo ra N2
Hướng dẫn giải
A. 4NH3 + 3O2 ⟶ 2NO + 6H2O
B. NH4NO3 ⟶ N2O + 2H2O
C. AgNO3 ⟶ Ag + NO2 + O2
D. NH4NO2 ⟶ N2 + 2H2O
Đáp án cần chọn là D.
3. Giải bài 2.48 trang 20 SBT Hóa học 11
Cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch ?
A. axit nitric và đồng(II) nitrat
B. đồng (II) nitrat và amoniac
C. bari hiđroxit và axit photphoric.
D. amoni hiđrophotphat và kali hiđroxit
Phương pháp giải
Cặp chất cùng tồn tại trong dung dịch khi 2 chất đó không xảy ra phản ứng.
(Nếu xảy ra phản ứng với nhau, thì chúng không thể cùng tồn tại trong dung dịch).
Hướng dẫn giải
Trong các cặp chất trên axit nitric và đồng(II) nitrat không phản ứng với nhau.
Đáp án A
4. Giải bài 2.49 trang 20 SBT Hóa học 11
Viết phương trình hoá học ở dạng phân tử và dạng ion rút gọn của phản ứng xảy ra trong dung dịch giữa các chất sau:
1. bari clorua và natri photphat.
2. axit photphoric và canxi hiđroxit, tạo ra muối axit ít tan.
3. axit nitric đặc, nóng và sắt kim loại.
4. natri nitrat, axit sunfuric loãng và đồng kim loại.
Phương pháp giải
Dựa vào tính chất hóa học của nito và các hợp chất của nito đề viết các phương trình hóa học của phản ứng
Hướng dẫn giải
Phương trình hoá học ở dạng phân tử và dạng ion rút gọn của các phản ứng xảy ra trong dung dịch :
1. 3BaCl2 + 2Na3PO4 → 6NaCl + Ba3(PO4)2↓
3Ba2+ + 2PO43− → Ba3(PO4)2↓
2. H3PO4 + Ca(OH)2 → CaHPO4↓ + 2H2O
H3PO4 + Ca2+ + 2OH− → CaHPO4↓ + 2H2O
3. 6HNO3 (đặc) + Fe to→ Fe(NO3)3 + 3NO2↑ + 3H2O
6H+ + 3NO3− + Fe → Fe3+ + 3NO2↑ + 3H2O
4. 3Cu + 4H2SO4 (loãng) + 8NaNO3 → 3Cu(NO3)2 + 2NO↑ + 4Na2SO4 + 4H2O
3Cu + 8H+ + 2NO3− → 3Cu2+ + 2NO↑ + 4H2O
5. Giải bài 2.50 trang 20 SBT Hóa học 11
Có 4 lọ không dán nhãn đựng riêng biệt từng dung dịch loãng của các chất sau: H3PO4, BaCl2, Na2CO3, (NH4)2SO4. Chỉ được sử dụng dung dịch HCl, hãy nêu cách nhận biết chất đựng trong mỗi lọ. Viết phương trình hoá học của các phản ứng.
Phương pháp giải
- Dùng HCl nhận ra Na2CO3
- Dùng Na2CO3 nhận ra H3PO4 và BaCl2
- Còn lại (NH4)2SO4
Hướng dẫn giải
- Lấy một phần mỗi dung dịch vào từng ống nghiệm, rồi nhỏ dung dịch HCl vào. Ở ống nghiệm có khí thoát ra là ống đựng dung dịch Na2CO3.
- Phân biệt dung dịch H3PO4, BaCl2 và (NH4)2SO4 bằng cách cho Na2CO3 tác dụng với từng dung dịch: dung dịch nào khi phản ứng cho khí thoát ra là H3PO4, dung dịch nào khi phản ứng có kết tủa trắng xuất hiện là BaCl2, dung dịch nào khi phản ứng không có hiện tượng gì là (NH4)2SO4
Phương trình hóa học:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
2H3PO4 + 3Na2CO3 → 2Na3PO4 + 3CO2↑ + 3H2O
BaCl2 +NaCO3 → BaCO3↓ + 2NaCl
6. Giải bài 2.51 trang 20 SBT Hóa học 11
Cho các chất sau: 3Ca3(PO4)2.CaF2, H3PO4, NH4H2PO4, NaH2PO4, K3PO4, Ag3PO4. Hãy lập một dãy chuyển hoá biểu diễn mối quan hệ giữa các chất đó. Viết phương trình hoá học của các phản ứng thực hiện dãy chuyển hoá trên.
Phương pháp giải
Gợi ý: 3Ca3(PO4)2.CaF2 → H3PO4 → NH4H2PO4 → NaH2PO4 → K3PO4 → Ag3PO4
Hướng dẫn giải
Dãy chuyển hoá biểu diễn mối quan hệ giữa các chất có thể là :
3Ca3(PO4)2.CaF2 → H3PO4 → NH4H2PO4 → NaH2PO4 → K3PO4 → Ag3PO4
Các phương trình hoá học:
(1) 3Ca3(PO4)2.CaF2 + 10H2SO4(đặc) → 6H3PO4 + 10CaS04↓ + 2HF↑
(2) H3PO4 + NH3 → NH4H2PO4
(3) NH4H2PO4 + NaOH → NaH2PO4 + NH3↑ + H2O
(4) 3NaH2PO4 + 6KOH → Na3PO4 + 2K3PO4 + 6H2O
(5) K3PO4 + 3AgNO3 → Ag3PO4↓ + 3KNO3
7. Giải bài 2.52 trang 20 SBT Hóa học 11
Hoà tan 12,8 g kim loại hoá trị II trong một lượng vừa đủ dung dịch HNO3 60,0% (D = 1,365 g/ml), thu được 8,96 lít (đktc) một khí duy nhất màu nâu đỏ. Tên của kim loại và thể tích dung dịch HNO3 đã phản ứng là
A. đồng; 61,5 ml.
B. chì; 65,1 ml.
C. thuỷ ngân; 125,6 ml.
D. sắt; 82,3 ml.
Phương pháp giải
- PTHH: \(M + 4HN{O_3} \to M{(N{O_3})_2} + 2N{O_2} \uparrow + 2{H_2}O\)
- Tính số mol khí \(N{O_2}\) → \({n_M}\) = 0,2 mol và \({n_{HN{O_3}}}\)
- Áp dụng CT: m = M.n → M → Xác định kim loại
- Áp dụng CT:
\(\begin{array}{l}C\% = \dfrac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}}.100\% \\D = \dfrac{m}{V}\end{array}\)
→ VHCl
Hướng dẫn giải
Phương trình hóa học:
M + 4HNO3 → M(NO3)2 + 2NO2↑ + 2H2O (màu nâu đỏ)
nNO2 = 8,96 : 22,4 = 0,4 mol
Theo phương trình hoá học :
nM = 0,2 mol và nHNO3 = 0.4.4 : 2 = 0,8 mol
Khối lượng mol nguyên tử của kim loại M
M = 12,8 : 0,2 = 64 (g/mol)
⇒ kim loại là Cu (đồng).
Gọi V (ml) là thể tích của dung dịch HNO3 60,0%.
Ta có phương trình liên hệ V với nHNO3:
(V.1,365.60) : (100.63) = 0,8
⇒ V = 61,5 ml
8. Giải bài 2.53 trang 20 SBT Hóa học 11
Rót dung dịch chứa 11,76 g H3PO4 vào dung dịch chứa 16,8 g KOH. Sau phản ứng cho dung dịch bay hơi đến khô. Tính khối lượng muối khan thu được.
Phương pháp giải
- Tính số mol \({H_3}P{O_4}\) và số mol KOH
- Xét tỉ lệ T= \({n_{KOH}}:{n_{{H_3}P{O_4}}}\) → Công thức của muối tạo thành sau phản ứng.
- Gọi x là số mol H3PO4 tham gia phản ứng (2) và y là số mol H3PO4 tham gia phản ứng (3). Lập hpt → x, y → Khối lượng hai muối.
Hướng dẫn giải
Số mol H3PO4 = 11,76 : 98 = 0,12 mol
Số mol KOH= 16,8 : 56 = 0,3 mol
Các phản ứng có thể xảy ra :
H3PO4 + KOH → KH2PO4 + H2O (1)
H3PO4 + 2KOH → K2HPO4 + 2H2O (2)
H3PO4 + 3KOH → K3PO4 + 3H2O (3)
Vì tỉ lệ nKOH : nH3PO4 = 0,3 : 0,12 = 2,5 nằm giữa 2 và 3, nên chỉ xảy ra các phản ứng (2) và (3), nghĩa là tạo ra hai muối K2HPO4 và K3PO4.
Gọi x là số mol H3PO4 tham gia phản ứng (2) và y là số mol H3PO4 tham gia phản ứng (3) :
x + y = 0,12 (a)
Theo các phản ứng (2) và (3) tổng số mol KOH tham gia phản ứng :
2x + 3y = 0,3 (b)
Giải hộ phương trình (a) và (b): x = 0,06 mol K2HPO4 ; y = 0,06 mol K3PO4.
Tổng khối lượng hai muối:
mK2HPO4 + mK3PO4 = 0,06 x 174 + 0,06 x 212 = 10,44 + 12,72 = 23,16 (g).
Tham khảo thêm
- doc Giải bài tập SBT Hóa 11 Bài 7: Nitơ
- doc Giải bài tập SBT Hóa 11 Bài 8: Amoniac và muối amoni
- doc Giải bài tập SBT Hóa 11 Bài 9: Axit nitric và muối nitrat
- doc Giải bài tập SBT Hóa 11 Bài 10: Photpho
- doc Giải bài tập SBT Hóa 11 Bài 11: Axit photphoric và muối photphat
- doc Giải bài tập SBT Hóa 11 Bài 12: Phân bón hóa học
