Giải bài tập SBT Hóa 11 Bài 46: Luyện tập: Anđehit - Xeton - Axit cacboxylic
Lời giải chi tiết và chính xác cho 14 bài tập trang 71, 72 SBT Hóa lớp 11 đã được eLib sưu tầm và tổng hợp dưới đây sẽ giúp các em học tập thật tốt chuyên đề Anđehit - Xeton - Axit cacboxylic. Mời các bạn tải về tham khảo chuẩn bị cho bài học sắp tới.
Mục lục nội dung
1. Giải bài 9.27 trang 71 SBT Hóa học 11
2. Giải bài 9.28 trang 71 SBT Hóa học 11
3. Giải bài 9.29 trang 71 SBT Hóa học 11
4. Giải bài 9.30 trang 71 SBT Hóa học 11
5. Giải bài 9.31 trang 71 SBT Hóa học 11
6. Giải bài 9.32 trang 71 SBT Hóa học 11
7. Giải bài 9.33 trang 71 SBT Hóa học 11
8. Giải bài 9.34 trang 72 SBT Hóa học 11
9. Giải bài 9.35 trang 72 SBT Hóa học 11
10. Giải bài 9.36 trang 72 SBT Hóa học 11
11. Giải bài 9.37 trang 73 SBT Hóa học 11
12. Giải bài 9.38 trang 73 SBT Hóa học 11

1. Giải bài 9.27 trang 71 SBT Hóa học 11
Trong các nhận xét dưới đây, nhận xét nào không đúng ?
A. Tất cả các anđehit no, đơn chức, mạch hở đều có các đồng phân thuộc chức xeton và chức ancol.
B. Tất cả các xeton no đơn chức, mạch hở đều có các đồng phân thuộc chức anđehit và chức ancol.
C. Tất cả các ancol đơn chức, mạch hở có 1 liên kết đôi đều có các đồng phân thuộc chức anđehit và chức xeton.
D. Tất cả các ancol đơn chức, mach vòng no đều có các đồng phân thuộc chức anđehit và chức xeton.
Phương pháp giải
Học sinh tự tổng hợp kiến thức của chương 9: Anđehit – xeton – axit cacboxylic để trả lời câu hỏi.
Hướng dẫn giải
Tất cả các anđehit no, đơn chức, mạch hở đều có các đồng phân thuộc chức xeton và chức ancol → sai.
Ví dụ: HCHO, CH3CHO không có đồng phân thuộc chức xeton và ancol.
Đáp án A
2. Giải bài 9.28 trang 71 SBT Hóa học 11
Chất X là một anđehit mạch hở chứa a nhóm chức anđehit và b liên kết C=C ở gốc hiđrocacbon. Công thức phân tử của chất X có dạng là ?
A. CnH2n−2a−2bOa
B. CnH2n−a−bOa
C. CnH2n+2−a−bOa
D. CnH2n+2−2a−2bOa
Phương pháp giải
Anđehit là những hợp chất hữu cơ mà phân tử có nhóm CH= O liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro nên có công thức tổng quát là: R(CHO)n.
Hướng dẫn giải
Anđehit mạch hở chứa a nhóm chức anđehit và b liên kết ở gốc hiđrocacbon có CTPT là: CnH2n+2−2a−2bOa
Đáp án D
3. Giải bài 9.29 trang 71 SBT Hóa học 11
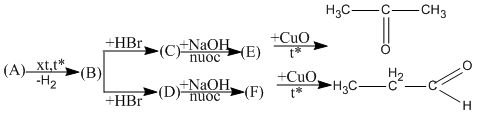
Viết phương trình hóa học thực hiện các biến đổi dưới đây. Các chất hữu cơ được viết dưới dạng công thức cấu tạo và ghi tên.
Phương pháp giải
Học sinh tổng hợp kiến thức của chương 9: Anđehit - xeton - axit cacboxylic để viết PTHH
Hướng dẫn giải
CH3−CH2−CH3 → CH3−CH=CH2 (đk: 500oC, xt)
A: propan
CH3−CH=CH2 + HBr → CH3 - CHBr - CH3
B: propen
CH3 - CHBr - CH3 + NaOH → CH3 - CHOH - CH3 + NaBr
C: 2-brompropan
CH3 - CHOH - CH3 + CuO (to) → CH3 - CO - CH3 + Cu + H2O
E: propan-2-ol
CH3−CH=CH2 + HBr → CH3−CH2−CH2−Br
CH3−CH2−CH2−Br + NaOH → CH3−CH2−CH2−OH + NaBr
D: 1-brompropan
CH3−CH2−CH2−OH + CuO → CH3-CH2-CHO + Cu + H2O
4. Giải bài 9.30 trang 71 SBT Hóa học 11
Anđehit axetic có thể khử được đồng (II) hiđroxit tạo ra kết tủa đồng (I) oxit có màu đỏ gạch.
Hãy viết phương trình hóa học biểu diễn phản ứng nói trên.
Phương pháp giải
Xem lại lí thuyết về Anđehit - Xeton
Hướng dẫn giải
CH3-CHO + 2Cu(OH)2 + NaOH → CH3COONa + Cu2O + 3H2O
5. Giải bài 9.31 trang 71 SBT Hóa học 11
Chất hữu cơ A chỉ chứa cacbon, hiđro, oxi và chỉ có một loại nhóm chức.
Cho 0,9 g chất A tác dụng với lượng dư dung dịch AgNO3 trong amoniac, thu được 5,4g Ag.
Cho 0,2 mol A tác dụng với H2 có dư ( xúc tác Ni nhiệt độ ) ta được ancol B. Cho ancol B tác dụng với Na ( lấy dư ) thu được 4,48 lít H2 (đktc).
Xác định công thức và tên chất A.
Phương pháp giải
- A chỉ chứa cacbon, hiđro, oxi và chỉ có một loại nhóm chức, A tác dụng với dung dịch AgNO3 trong amoniac tạo ra Ag → A chứa nhóm chức anđehit.
- B có công thức R(CH2OH)x
- Viết PTHH: R(CHO)2 + 4AgNO3 + 6NH3 + 2H2O → R(COONH4)2 + 4NH4NO3 + 4Ag
- Tính theo PTHH → Khối lượng mol của A → R.
Hướng dẫn giải
A tác dụng với dung dịch AgNO3 trong amoniac tạo ra Ag ; vậy A có chức anđehit.
0,2 mol anđehit kết hợp với hiđro phải tạo ra 0,2 mol ancol B có công thức R(CH2OH)x
R(CH2OH)x + xNa → R(CH2ONa)x + \(\dfrac{x}{2}\)H2
Theo phương trình 1 mol B tạo ra \(\dfrac{x}{2}\) mol H2
Theo đầu bài 0,2 mol B tạo ra 0,2 mol H2
\(\dfrac{1}{{0,2}} = \dfrac{x}{{0,4}} \Rightarrow x = 2\)
Vậy B là ancol hai chức và A là anđehit hai chức.
R(CHO)2 + 4AgNO3 + 6NH3 + 2H2O \( \to \) R(COONH4)2 + 4NH4NO3 + 4Ag\( \downarrow \)
Số mol anđehit A = \(\dfrac{x}{4}\)số mol Ag = \(\dfrac{1}{4}.\dfrac{{5,4}}{{108}}\) = 0,0125 (mol)
Khối lượng 1 mol A = \(\dfrac{{0,9}}{{0,0125}}\) = 72(g).
R(CHO)2 = 72 → R = 72 - 2.29 = 14. Vậy R là CH2
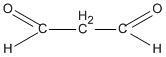 propanđial
propanđial
6. Giải bài 9.32 trang 71 SBT Hóa học 11
Chất hữu cơ X chỉ có chức anđehit. Biết 0,1 mol X có thể kết hợp với 4,48 lít H2 (lấy ở đktc) khi có chất xúc tác Ni và nhiệt độ thích hợp.
Mặt khác, nếu cho 7 g X tác dụng với lượng dư dung dịch AgNO3 trong amoniac, thu được 27g Ag.
Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất X.
Phương pháp giải
Theo đầu bài 0,1 mol anđehit X kết hợp được với 0,2 mol H2. Vậy X có thể là:
- Anđehit no hai chức CnH2n (CHO)2 hoặc
- Anđehit đơn chức có 1 liên kết đôi ở gốc CnH2n-1CHO.
Viết PTHH, tính toán đối với từng trường hợp trên kết luận CTPT của X.
Hướng dẫn giải
Theo đầu bài 0,1 mol anđehit X kết hợp được với 0,2 mol H2. Vậy X có thể là :
- Anđehit no hai chức CnH2n (CHO)2 hoặc
- Anđehit đơn chức có 1 liên kết đôi ở gốc CnH2n-1CHO.
1. Nếu X là CnH2n(CHO)2 thì :
\({C_n}{H_{2n}}{(CHO)_2} + 4AgN{O_3} + 6N{H_3} + 2{H_2}O \to {C_2}{H_{2n}}{(COON{H_4})_2} + 4N{H_4}N{O_3} + 4Ag \downarrow \)
Số mol X = \(\dfrac{1}{4}\)số mol Ag = \(\dfrac{1}{4}.\dfrac{{27}}{{108}} = {6,25.10^{ - 2}}\) (mol).
Mx = \(\dfrac{7}{{{{6,25.10}^{ - 2}}}}\) =112 (g/mol)
\({M_{{C_n}{H_{2n}}{{(CHO)}_2}}}\) = 112 (g/mol) hay 14n + 2.29 = 112 \( \Rightarrow \) n = 3,86 (loại)
2. Nếu X là CnH2n-1CHO :
\({C_n}{H_{2n - 1}}CHO + 2AgN{O_3} + 3N{H_3} + {H_2}O \to {C_n}{H_{2n - 1}}COON{H_4} + 2N{H_4}N{O_3} + 2Ag \downarrow \)
Số mol X = \(\dfrac{1}{2}\)Số mol Ag = \(\dfrac{1}{2}.\dfrac{{27}}{{108}} = {1,25.10^{ - 1}}\) (mol).
Mx = \(\dfrac{7}{{{{1,25.10}^{ - 1}}}}\) = 56 (g/mol)
\({M_{{C_n}{H_{2n - 1}}CHO}}\) = 56 (g/mol) → 14n + 28 = 56 → n = 2
CTPT : C3H4O
CTCT: CH2 = CH-CHO propenal.
7. Giải bài 9.33 trang 71 SBT Hóa học 11
Hỗn hợp M chứa ba hợp chất hữu cơ X, Y và Z. Hai chất X và Y kế tiếp nhau trong một dãy đồng đẳng ( MY < MX ). Chất Z là đồng phân của chất Y.
Nếu làm bay hơi 3,2 g M thì thể tích hơi thu được đúng bằng thể tích của 1,68g khí nitơ ở cùng điều kiện.
Để đốt cháy hoàn toàn 16g M cần dùng vừa hết 23,52 lít O2 (đktc). Sản phẩm cháy chỉ có CO2 và H2O với số mol bằng nhau.
Nếu cho 48g M tác dụng với Na (lấy dư), thu được 1,68 lít H2 (đktc).
Hãy xác định công thức phân tử, công thức cấu tạo, tên và phần trăm về khối lượng của từng chất trong hỗn hợp M.
Phương pháp giải
- Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz. Chất Z là đồng phân của Y nên CTPT giống chất Y.
- Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z
- Viết PTHH:
\({C_x}{H_y}{O_z} + (x + \frac{y}{4} - \dfrac{z}{2}){O_2} \to xC{O_2} + \frac{y}{2}{H_2}O\)
\({C_{x + 1}}{H_{y + 2}}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2} + 1,5){O_2}\)\( \to (x + 1)C{O_2} + \dfrac{{y + 2}}{2}{H_2}O\)
- Dựa vào dữ kiện đề bài và PTHH, lập hpt ẩn x, y, z, a, b.
- Biện luận và giải hpt → CTPT của X, Y, Z.
- Tính phần trăm về khối lượng của từng chất trong hỗn hợp M.
Hướng dẫn giải
Số mol 3 chất trong 3,20 g hỗn hợp M : \(\dfrac{{1,68}}{{28}}\) = 0,06 (mol).
Số mol 3 chất trong 16 g M : \(\dfrac{{0,06.16}}{{3,2}}\) = 0,3 (mol)
Khi đốt hỗn hợp M ta chỉ thu được CO2 và H2O.
Vậy, các chất trong hỗn hợp đó chỉ có thể chứa C, H và O.
Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz. Chất Z là đồng phân của Y nên công thức phân tử giống chất Y.
Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z :
\(\left\{ \begin{array}{l}
a + b = 0,3(1)\\
(12{\rm{x}} + y + 16{\rm{z}})a + (12{\rm{x}} + y + 16{\rm{z}} + 14)b = 16(2)
\end{array} \right.\)
Khi đốt 16 g M thì tổng khối lượng CO2 và H2O thu được bằng tổng khối lượng của M và O2 và bằng :
\(16 + \dfrac{{23,52}}{{22,4}}.32 = 49,6(g)\)
Mặt khác, số mol CO2 = số mol H2O = n : 44n + 18n = 49,6 → n = 0,8
\({C_x}{H_y}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O\)
a mol xa mol \(\dfrac{y}{2}\)a mol
\({C_{x + 1}}{H_{y + 2}}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2} + 1,5){O_2}\)\( \to (x + 1)C{O_2} + \dfrac{{y + 2}}{2}{H_2}O\)
b mol (x + 1)b mol \(\dfrac{{y + 2}}{2}\)b mol
Số mol CO2 là : xa + (x + 1)b = 0,8 (mol) (3)
Số mol H2O là : \(\dfrac{{y{\rm{a}} + (y + 2)b}}{2}\) = 0,8 (mol)
do đó : ya + (y + 2)b = 1,6 (4)
Giải hệ phương trình :
Biến đổi (3) ta có x(a + b) + b = 0,8
Vì a + b = 0,3 nên b = 0,8 - 0,3x
Vì 0 < b < 0,3 nên 0 < 0,8 - 0,3x < 0,3 → 1,66 < x < 2,66
x nguyên → x = 2 →b = 0,8 - 0,3.2 = 0,2
→ a = 0,3 - 0,2 = 0,1
Thay giá trị của a và b vào (4), tìm được y = 4.
Thay giá trị của a, b, x và y vào (2), tìm được z = 1.
Vậy chất X có CTPT là C2H4O, hai chất Y và Z có cùng CTPT là C3H6O.
Chất X chỉ có thể có CTCT là 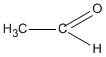 (etanal) vì chất CH2 = CH - OH không bền và chuyển ngay thành etanal.
(etanal) vì chất CH2 = CH - OH không bền và chuyển ngay thành etanal.
Chất Y là đồng đẳng của X nên CTCT là .bmp) (propanal).
(propanal).
Hỗn hợp M có phản ứng với Na. Vậy, chất Z phải là ancol CH2 = CH - CH2 - OH (propenol) :
2CH2 = CH - CH2 - OH + 2Na \( \to \) 2CH2 = CH - CH2 - ONa + H2\( \uparrow \)
Số mol Z trong 48 g M là : 2.số mol H2 = 2.\(\dfrac{{1,68}}{{22,4}}\) =0,15 (mol).
Số mol Z trong 16 g M là : \(\dfrac{{0,15.16}}{{48}}\) = 0,05 (mol)
Số mol Y trong 16 g M là : 0,2 - 0,05 = 0,15 (mol).
Thành phần khối lượng của hỗn hợp M :
Chất X chiếm : \(\dfrac{{0,1.44}}{{16}}\). 100% = 27,5%.
Chất Y chiếm : \(\dfrac{{0,15.58}}{{16}}\). 100% = 54,4%.
Chất Z chiếm : \(\dfrac{{0,05.58}}{{16}}\). 100% = 18,1%.
8. Giải bài 9.34 trang 72 SBT Hóa học 11
Độ linh động của nguyên tử H trong nhóm OH của các chất C2H5OH, C6H5OH, HCOOH và CH3COOH tăng dần theo trật tự :
A. C2H5OH < C6H5OH < HCOOH < CH3COOH
B. CH3COOH < HCOOH < C6H5OH < C2H5OH.
C. C2H5OH < C6H5OH < CH3COOH < HCOOH.
D. C6H5OH < C2H5OH < CH3COOH < HCOOH.
Phương pháp giải
Xét khả năng đẩy, hút e của R(H) đính kèm phân tử.
Hướng dẫn giải
Đối với các chất có chức axit: CH3COOH có độ linh động kém hơn HCOOH vì CH3 đẩy e còn H không đẩy e.
Với các chất có dạng ROH sắp xếp theo thứ tự tăng dần: C2H5OH, C6H5OH do C2H5 đẩy e, C6H5 hút e.
Chọn C.
9. Giải bài 9.35 trang 72 SBT Hóa học 11
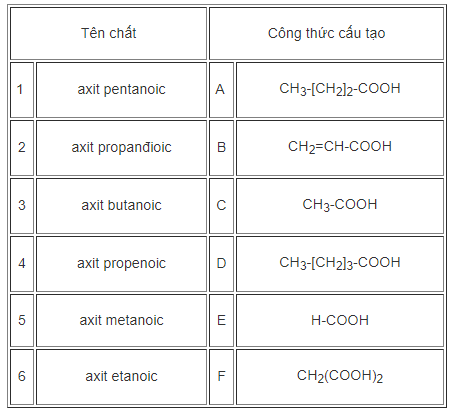
Ghép tên chất với công thức cấu tạo cho phù hợp.
Phương pháp giải
Xem lại lí thuyết về Anđehit - Xeton
Hướng dẫn giải
1 - D
2 - F
3 - A
4 - B
5 - E
6 - C
10. Giải bài 9.36 trang 72 SBT Hóa học 11
Viết phương trình hoá học thực hiện các biến hoá dưới đây (mỗi mũi tên là một phản ứng):
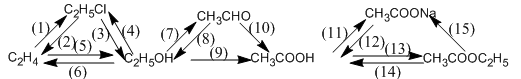
Phương pháp giải
Học sinh tổng hợp kiến thức của chương 9: Anđehit - xeton - axit cacboxylic và các hợp chất có liên quan để viết PTHH
Hướng dẫn giải
(1) CH2=CH2 + HCl xt→ CH3−CH2−Cl
(2) C2H5Cl + NaOH ancol→ CH2=CH2 + NaCl + H2O
(3) C2H5Cl + NaOH H2O→ C2H5OH + NaCl
(4) C2H5OH + HCl → C2H5Cl + H2O
(5) C2H4 + H2O (H+)→ C2H5OH
(6) C2H5OH (170o, H2SO4) → C2H4 + H2O
(7) C2H5OH + CuO (to) → CH3CHO + Cu + H2O
(8) CH3CHO + H2 (to, Ni) → C2H5OH
(9) C2H5OH + O2 → CH3COOH + H2O
(10) 2CH3CHO + H2 → 2CH3COOH
(11) CH3COOH + NaOH → CH3COONa + H2O
(12) CH3COONa + H2SO4 → CH3COOH + Na2SO4
(13) CH3COOH+ C2H5OH ↔ CH3COOC2H5 + H2O
(14) CH3COOC2H5 + H2O ↔ CH3COOH + C2H5OH
(15) CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
11. Giải bài 9.37 trang 73 SBT Hóa học 11
Có 4 bình (không ghi nhãn), mỗi bình đựng 1 trong các dung dịch (dung môi là nước): propan-1-ol, propanal, axit propanoic và axit propenoic.
Trình bày phương pháp hoá học để nhận biết các dung dịch đó. Viết phương trình hoá học của các phản ứng.
Phương pháp giải
Gợi ý: dùng các hóa chất: AgNO3 trong amoniac, nước brom, CaCO3
Hướng dẫn giải
Cho 4 dung dịch thử phản ứng với dung dịch AgNO3 trong amoniac; dung dịch nào có phản ứng tráng bạc là dung dịch propanal (3 dung dịch còn lại không phản ứng)
Thử 3 dung dịch còn lại với nước brom, chỉ có axit propenoic làm mất màu nước brom
Thử 2 dung dịch còn lại với CaCO3, chỉ có axit propanoic hoà tan CaCO3tạo ra chất khí
Dung dịch cuối cùng là dung dịch propan-1-ol.
C2H5CHO + 2AgNO3 + 3NH3 + H2O → C2H5COONH4 + 2NH4NO3 + 2Ag↓
CH2 = CH - COOH + Br2 → CH2Br - CHBr - COOH
2C2H5COOH + CaCO3 → (C2H5COO)2Ca + H2O + CO2↑
12. Giải bài 9.38 trang 73 SBT Hóa học 11
Chất A là một axit cacboxylic no, mạch hở. Để trung hoà 50g dung dịch A có nồng độ 5,20% cần dùng vừa đúng 50 ml dung dịch NaOH 1 M. Mặt khác, nếu đốt cháy hoàn toàn 15,6 g chất A, thu được 10,080 lít CO2 (đktc).
Hãy xác định công thức phân tử và công thức cấu tạo của A.
Vận dụng quy tắc đọc tên thay thế của axit, hãy cho biết tên của A.
Phương pháp giải
- A là CnH2n+2-x(COOH)x ; CTPT là Cn+xH2n+2O2x
- Tính số mol NaOH trong 50 ml dung dịch 1 M
- Các PTHH:
\({C_n}{H_{2n + 2 - x}}{(COOH)_x} + xNaOH \to {C_n}{H_{2n + 2 - x}}{(COONa)_x} + x{H_2}O\)
\({C_{n + x}}{H_{2n + x}}{O_{2{\rm{x}}}} + \dfrac{{3n + 1}}{2}{O_2} \to (n + x)C{O_2} + (n + 1){H_2}O\)
- Dựa vào dữ kiện đề bài và PTHH lập hpt ẩn x, n
- Giải hpt → CTPT A
- Viết CTCT A và đọc tên
Hướng dẫn giải
A là axit no, mạch hở, chưa rõ là đơn chức hay đa chức ; vậy chất A là CnH2n+2-x(COOH)x ; CTPT là Cn+xH2n+2O2x
Khối lượng mol A là (14n + 44c + 2) gam. Khối lượng A trong 50 g dung dịch 5,2% là \(\dfrac{{50.5,2}}{{100}} = 2,6(g)\)
Số mol NaOH trong 50 ml dung dịch 1 M là : \(\dfrac{{1.50}}{{1000}}\) = 0,05 (mol).
\({C_n}{H_{2n + 2 - x}}{(COOH)_x} + xNaOH \to {C_n}{H_{2n + 2 - x}}{(COONa)_x} + x{H_2}O\)
Theo phương trình : cứ (14n + 44x + 2) g A tác dụng với x mol NaOH
Theo đầu bài : cứ 2,6 g A tác dụng với 0,05 mol NaOH
\(\dfrac{{14n + 44{\rm{x}} + 2}}{{2,6}} = \dfrac{x}{{0,05}}(1)\)
\({C_{n + x}}{H_{2n + x}}{O_{2{\rm{x}}}} + \dfrac{{3n + 1}}{2}{O_2} \to (n + x)C{O_2} + (n + 1){H_2}O\)
Theo phương trình : Khi đốt (14n + 44x + 2) g A thu được (n + x) mol CO2
Theo đầu bài : Khi đốt 15,6 g A thu được \(\dfrac{{10,08}}{{22,4}}\) =0,45 (mol) CO2
\(\dfrac{{14n + 44{\rm{x}} + 2}}{{15,6}} = \dfrac{{n + x}}{{0,45}}(2)\)
Từ (1) và (2), tìm được n = 1, x = 2 CTPT cùa A : C3H4O4
CTCT của A : HOOC - CH2 - COOH (Axit propanđioic)
13. Giải bài 9.39 trang 73 SBT Hóa học 11
Hỗn hợp M chứa ancol no A và axit cacboxylic đơn chức B, cả hai đều mạch hở. Tổng số mol 2 chất trong hỗn hợp M là 0,5 mol. Để đốt cháy hoàn toàn hỗn hợp M cần dùng vừa hết 30,24 lít O2. Sản phẩm cháy gồm có 23,4 g H2O và 26,88 lít CO2. Các thể tích đo ở đktc.
Hãy xác định công thức phân tử, công thức cấu tạo, tên gọi và phần trăm khối lượng từng chất trong hỗn hợp M, biết rằng chất B hơn chất A một nguyên tử cacbon.
Phương pháp giải
- Biện luận số nguyên tử cacbon trong A, B (A có 2 và B có 3 nguyên tử cacbon) → CTTQ của A, B ( A là ancol no có 2 cacbon: C2H6-x(OH)x hay C2H6Ox B là axit đơn chức có 3 cacbon : C3HyO2.)
- Viết các PTHH:
C2H6Ox + \(\dfrac{{7 - x}}{2}\)O2 → 2CO2 + 3H2O
C3HyO2+ \((2 + \dfrac{y}{4})\)O2 → 3CO2 + \(\dfrac{y}{2}\)H2O
- Gọi số mol A là a, số mol B là b, lập hpt ẩn a, b, x, y.
- Giải hpt → CTPT của A, B.
- Viết CTCT và gọi tên A, B.
Hướng dẫn giải
Khi đốt 0,5 mol hỗn hơp M, số mol CO2 thu đươc là : \(\dfrac{{26,88}}{{22,4}}\) = 1,2 (mol).
Nếu đốt 1 mol hỗn hợp M, số mol CO2 thu được sẽ là 2,4 (mol).
Như vậy chất A và chất B có chứa trung bình 2,4 nguyên tử cacbon , chất A lại kém chất B 1 nguyên tử cacbon. Vậy, A có 2 và B có 3 nguyên tử cacbon.
A là ancol no có 2 cacbon: C2H6-x(OH)x hay C2H6Ox
B là axit đơn chức có 3 cacbon: C3HyO2.
Đặt số mol A là a, số mol B là b:
a + b = 0,5 (1)
C2H6Ox + \(\dfrac{{7 - x}}{2}\)O2 → 2CO2 + 3H2O
a mol \(\dfrac{{7 - x}}{2}a\) mol 2a mol 3a mol
C3HyO2+ \((2 + \dfrac{y}{4})\)O2 → 3CO2 + \(\dfrac{y}{2}\)H2O
b mol \((2 + \dfrac{y}{4})\)b mol 3b mol \(\dfrac{y}{2}\)bmol
Số mol O2 là : (3,5 - 0,5x)a + (2 + 0,25y)b = \(\dfrac{30,24}{22,4}\) = 1,35 (mol) (2)
Số mol CO2 là : 2a + 3b = 1,2 (mol) (3)
Số mol CO2 là : 3a + \(\dfrac{y}{2}\)b = \(\dfrac{23,4}{18}\) = 1,30 (mol) (4)
Giải hệ phương trình đại số tìm được : a = 0,3 ; b = 0,2 ; x = 2 ; y = 4.
Chất A : C2H6O2 hay 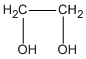 etanđiol (hay etylenglicol) chiếm \(\dfrac{{0,3.62}}{{0,3.62 + 0.2.72}}\). 100% = 56,4% khối lượng M.
etanđiol (hay etylenglicol) chiếm \(\dfrac{{0,3.62}}{{0,3.62 + 0.2.72}}\). 100% = 56,4% khối lượng M.
Chất B : C3H4O2 hay CH2 = CH - COOH, axit propenoic chiếm 43,64% khối lượng M.
14. Giải bài 9.40 trang 73 SBT Hóa học 11
Hỗn hợp M chứa 3 axit cacboxylic đơn chức mạch hở, trong đó hai chất là axit no kế tiếp nhau trong dãy đồng đẳng và một chất là axit không no có một liên kết kép ở gốc hiđrocacbon.
Cho 29,6 g M tác dụng với dung dịch NaOH rồi cô cạn, thu được 40,6 g hỗn hợp muối khan. Đốt cháy hoàn toàn 8,88 g M thu được 6,72 lít CO2 (đktc).
Xác định công thức phân tử, công thức cấu tạo, tên gọi và phần trăm khối lượng từng chất trong hỗn hợp M.
Phương pháp giải
- Viết PTHH của phản ứng
- Tính toán dựa vào phương trình
- Ta có hệ phương trình:
x + y + z = 0,15 (1)
46x + 60y + (14n + 44)z = 8,88 (2)
x + 2y + (n + 1)z = 0,3 (3)
→ Tìm được x, y, z = ?
→ Thành phần khối lượng của hỗn hợp?
Hướng dẫn giải
Các axit đơn chức tác dụng với NaOH như sau :
RCOOH + NaOH → RCOONa + H2O
Cứ 1 mol RCOOH biến thành 1 mol RCOONa thì khối lượng tăng thêm: 23 - 1 = 22 (g).
Khi 29,6g M biến thành hỗn hợp muối, khối lượng đã tăng thêm: 40,6 - 29,6= 11 (g).
Vậy số mol 3 axit trong 29,60g M là 11 : 22 = 0,5 mol
Khối lượng trung bình của 1 mol axit trong hỗn hợp là 29,6 : 0,5 = 59,2 gam
Vậy trong hỗn hợp M phải có axit có phân tử khối nhỏ hơn 59,2. Chất đó chỉ có thể là H-COOH. Nhưng M có 2 axit no kế tiếp nhau trong dãy đồng đẳng nên đã có HCOOH thì phải có CH3COOH.
Giả sử trong 8,88 g M có x mol HCOOH, y mol CH3COOH và z mol CnH2n-1COOH
Ta có hệ phương trình:
x + y + z = 0,15 (1)
46x + 60y + (14n + 44)z = 8,88 (2)
Ta có:
2HCOOH + O2 → 2CO2 + 2H2O
x mol x mol
CH3COOH + 2O2 → 2CO2 + 2H2O
y mol 2y mol
CnH2n-1COOH + 1,5nO2 → (n+1)CO2 + nH2O
z mol (n+1)z mol
x + 2y + (n + 1)z = 0,3 (3)
Cách giải hệ phượng trình :
Nhân 2 vế của phương trình (3) với 14 ta có
14x + 28y + (14n + 14)z = 4,2 (3’)
Lấy (2) trừ đi (3') :
32x + 32y + 30z = 4 68 (2')
Nhân (1) với 30 ta có:
30x + 30y + 30z = 4,50 (1')
Lấy (2') trừ đi (1'): 2x + 2y = 0,18 ⇒ x + y = 0,09 ⇒ z = 0,15 - 0,09 = 0,06
Thay các giá trị vừa tìm được vào phương trình (3), ta có :
0,09 + y + 0,06(n + 1) = 0,3
y = 0,15 - 0,06n
0 < y < 0,09 ⇒ 0 < 0,15 - 0,06n < 0,09
1 < n < 2,5
⇒ n = 2 ; y = 0,15 - 0,06.2 = 0,03 ⇒ x = 0,06.
Thành phần khối lượng của hỗn hợp:
H-COOH(CH2O2) axit metanoic là
\(\frac{{0,06.46}}{{8,88}}.100\% = 31,1\% \)
CH3-COOH(C2H4O2) axit etanoic là
\(\frac{{0,03.60}}{{8,88}}.100\% = 20,3\% \)
CH2 = CH-COOH(C3H4O2) axit propenoic là
\(\frac{{0,06.72}}{{8,88}}.100\% = 48,6\% \)
