Giải bài tập SBT Hóa 11 Bài 35: Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
Lời giải chi tiết và chính xác cho 11 bài tập trang 50 SBT Hóa lớp 11 đã được eLib sưu tầm và tổng hợp dưới đây sẽ giúp các em học tập thật tốt chuyên đề Benzen và đồng đẳng, một số hiđrocacbon thơm khác. Mời các bạn tải về tham khảo chuẩn bị cho bài học sắp tới.
Mục lục nội dung
1. Giải bài 7.1 trang 50 SBT Hóa học 11
2. Giải bài 7.2 trang 50 SBT Hóa học 11
3. Giải bài 7.3 trang 51 SBT Hóa học 11
4. Giải bài 7.4 trang 51 SBT Hóa học 11
5. Giải bài 7.5 trang 51 SBT Hóa học 11
6. Giải bài 7.6 trang 51 SBT Hóa học 11
7. Giải bài 7.7 trang 51 SBT Hóa học 11
8. Giải bài 7.8 trang 52 SBT Hóa học 11
9. Giải bài 7.9 trang 52 SBT Hóa học 11

1. Giải bài 7.1 trang 50 SBT Hóa học 11
Chất sau có tên là gì?
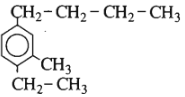
A. 1-butyl-3-metyl-4-etylbenzen.
B. 1-butyl-4-etyl-3-metylbenzen.
C. 1-etyl-2-metyl-4-butylbenzen.
D. 4-butyl-1-etyl-2-metylbenzen.
Phương pháp giải
- Xem lại lí thuyết về Benzen và đồng đẳng
- Tên gọi: Tên vị trí – tên nhánh + benzen
Hướng dẫn giải
Chất sau
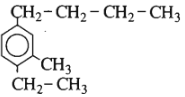
Có tên gọi là 4-butyl-1-etyl-2-metylbenzen.
Đáp án cần chọn là D.
2. Giải bài 7.2 trang 50 SBT Hóa học 11
Chất sau có tên là gì?
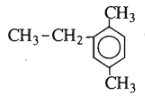
A. 1,4-đimetyl-6-etylbenzen.
B. 1,4-đimety1-2-etylbenzen.
C. 2-etyl-1,4-đimetylbenzen.
D. 1-etyl-2,5-đimetylbenzen.
Phương pháp giải
- Xem lại lí thuyết về Benzen và đồng đẳng
- Tên gọi: Tên vị trí – tên nhánh + benzen
Hướng dẫn giải

có tên gọi là 2-etyl-1,4-đimetylbenzen.
Đáp án cần chọn là C.
3. Giải bài 7.3 trang 51 SBT Hóa học 11
Stiren có công thức phân tử C8H8 và có công thức cấu tạo: C6H5-CH=CH2. Nhận xét nào cho dưới đây đúng ?
A. Stiren là đồng đẳng của benzen.
B. Stiren là đồng đẳng của etilen.
C. Stiren là hiđrocacbon thơm.
D. Stiren là hiđrocacbon không no.
Phương pháp giải
- Xem lại lí thuyết về Benzen và đồng đẳng
- Đồng phân gồm: Đồng phân vị trí nhóm ankyl trong vòng benzen và đồng mạch cacbon của nhánh.
- Đồng đẳng của benzen gồm các hydrocacbon có 1 vòng benzen và nhánh no (gốc ankyl)
Hướng dẫn giải
Stiren có công thức phân tử C8H8 và có công thức cấu tạo: C6H5-CH=CH2 → Stiren là hiđrocacbon thơm.
Đáp án C
4. Giải bài 7.4 trang 51 SBT Hóa học 11
m-Xilen có công thức cấu tạo là?
A. .png)
B. .png)
C. .png)
D. .png)
Phương pháp giải
- Xem lại lí thuyết về Benzen và đồng đẳng
- Đồng đẳng của benzen gồm các hydrocacbon có 1 vòng benzen và nhánh no (gốc ankyl)
Hướng dẫn giải
m-Xilen có công thức cấu tạo là
.png)
→ Đáp án C
5. Giải bài 7.5 trang 51 SBT Hóa học 11
Hoàn thành các phương trình hoá học dưới đây. Viết các chất sản phẩm hữu cơ ở dạng công thức cấu tạo và kèm theo tên.
1. C6H6 + Cl2 Fe→
(1 mol) (1 mol)
2. C6H6 + Cl2 as→
(1 mol) (3 mol)
3. C6H5−CH3 + Cl2 as→
(1 mol) (1 mol)
4. C6H5−CH3 + H2 (dư) → (đk: Ni, 300oC)
5. C6H5−CH3 + KMnO4 (dd) to →
Phương pháp giải
Xem lại lí thuyết về Benzen và đồng đẳng → từ đó viết PTHH minh họa
Hướng dẫn giải
1. C6H6 + Cl2 → 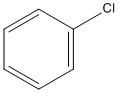 + HCl
+ HCl
clobenzen(phenyl clorua)
2. C6H6 + Cl2 → 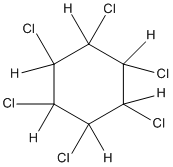
1,2,3,4,5,6-hexacloxiclohexan
3. C6H5−CH3 + Cl2 → 2 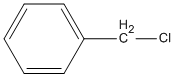 + HCl
+ HCl
benzyl clorua
4. C6H5−CH3 + H2 (dư) → 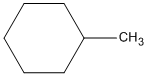
metylxiclohexan
5. C6H5−CH3 + KMnO4 (dd) → 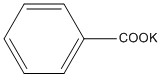 + 2MnO2 + KOH + H2O
+ 2MnO2 + KOH + H2O
6. Giải bài 7.6 trang 51 SBT Hóa học 11
Benzen không tác dụng với dung dịch Br2 và dung dịch KMnO4 nhưng stiren thì có phản ứng với cả hai dung dịch đó.
1. Giải thích vì sao stiren có khả năng phản ứng đó.
2. Viết phương trình hoá học biểu diễn các phản ứng đó.
Phương pháp giải
Gợi ý: Do Stiren có chứa liên kết đôi.
Hướng dẫn giải
1. Vì stiren có liên kết đôi ở nhánh vinyl.
2. C6H5−CH=CH2 + Br2 → C6H5-CHBr-CH2Br
3C6H5−CH=CH2 + 2KMnO4 + 4H2O → C6H5-CH(OH)-CH2OH + 2MnO2 + KOH
7. Giải bài 7.7 trang 51 SBT Hóa học 11
Chất A là một đồng đẳng của benzen. Để đốt cháy hoàn toàn 13,25 g chất A cần dùng vừa hết 29,40 lít O2 (đktc).
1. Xác định công thức phân tử chất A.
2. Viết các công thức cấu tạo có thể có của chất A. Ghi tên ứng với mỗi công thức cấu tạo đó.
Phương pháp giải
1. Viết PTHH: \({C_n}{H_{2n - 6}} + \dfrac{{3n - 3}}{2}{O_2} \to nC{O_2} + (n - 3){H_2}O\)
Tính theo PTHH, lập phương trình \( \to\) n \( \to\) CTPT của chất.
2. Học sinh viết CTCT
Hướng dẫn giải
1. \({C_n}{H_{2n - 6}} + \dfrac{{3n - 3}}{2}{O_2} \to nC{O_2} + (n - 3){H_2}O\)
Theo phương trình: Cứ (14n - 6)g A tác dụng với \(\dfrac{{3n - 3}}{2}\) mol \({O_2}\)
Theo đầu bài: Cứ 13,25g A tác dụng với \(\dfrac{{29,4}}{{22,4}}\) = 1,3125 mol \({O_2}\)
Ta có \(\dfrac{{14n - 6}}{{13,25}} = \dfrac{{3n - 3}}{{2.1,3125}} \Rightarrow n = 8 \Rightarrow \) CTPT: \({C_8}{H_{10}}\)
2. Các công thức cấu tạo
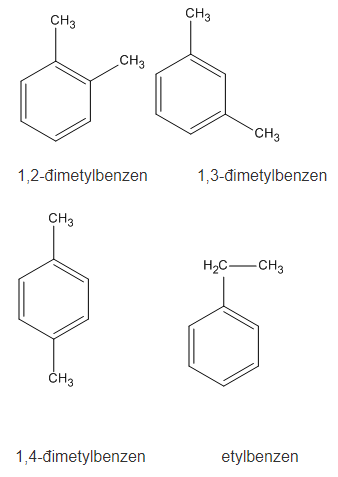
8. Giải bài 7.8 trang 52 SBT Hóa học 11
Khi đốt cháy hoàn toàn hiđrocacbon A, thu được khí CO2 và hơi nước theo tỉ lệ 77 : 18 về khối lượng. Nếu làm bay hơi hết 5,06 gam A thì thể tích hơi thu được đúng bằng thể tích của 1,76g O2 ở cùng nhiệt độ và áp suất.
1. Xác định công thức phân tử của chất A.
2. Chất A không tác dụng với nước brom nhưng tác dụng được với dung dịch KMnO4 khi đun nóng. Viết công thức cấu tạo và tên chất A.
Phương pháp giải
1. Viết PTHH: \({C_x}{H_y} + (x + \dfrac{y}{4}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O\)
Dựa vào dữ kiện: "khí CO2 và hơi nước theo tỉ lệ 77 : 18 về khối lượng" → x, y → CTPT
2. Học sinh viết CTCT của chất
Hướng dẫn giải
1. \({C_x}{H_y} + (x + \dfrac{y}{4}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O\)
\({M_A} = \dfrac{{32.5,06}}{{1,76}}\) = 92 (g/mol) tức là 12x + y = 92,0 \( \Rightarrow \) x = 7 ; y = 8
Công thức phân tử chất A là \({C_7}{H_8}\).
2. 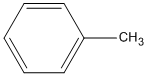
metylbenzen (toluen)
9. Giải bài 7.9 trang 52 SBT Hóa học 11
Hỗn hợp M ở thể lỏng, chứa hai hiđrocacbon kế tiếp nhau trong một dãy đồng đẳng. Đốt cháy hoàn toàn 2,62 g M, thu được 8,8 g CO2. Nếu làm bay hơi hết 6,55 gam M thì thể tích hơi thu được đúng bằng thể tích của 2,4 g khí oxi ở cùng điều kiện. Xác định công thức phân tử và phần trăm (về khối lượng) của từng chất trong hỗn hợp M.
Phương pháp giải
- Tính số mol 2 chất trong 2,62 gam M
- Giả sử trong 2,62 g M có a mol CxHy và b mol Cx+1 Hy+2
- Viết PTHH:
\({C_x}{H_y} + (x + \dfrac{y}{4}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O\)
\({C_{x + 1}}{H_{y + 2}} + (x + \dfrac{y}{4} + 1,5){O_2} \to (x + 1)C{O_2} + \dfrac{{y + 2}}{2}{H_2}O\)
- Khai thác dữ kiện đề bài → x, y, a, b
→ công thức phân tử và phần trăm (về khối lượng) của từng chất trong hỗn hợp M.
Hướng dẫn giải
Số mol 2 chất trong 6,55 g M là: \(\dfrac{{2,4}}{{32}}\) = 0,075 (mol).
Số mol 2 chất trong 2,62 g M là: \(\dfrac{{0,075.2,62}}{{6,55}}\) = 0,03 (mol).
Giả sử trong 2,62 g M có a mol CxHy và b mol Cx+1 Hy+2
\(\left\{ \begin{array}{l}
a + b = 0,03(1)\\
(12{\rm{x}} + y)a + (12{\rm{x}} + y + 14)b = 2,62(2)
\end{array} \right.\)
\({C_x}{H_y} + (x + \dfrac{y}{4}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O\)
a mol xa mol
\({C_{x + 1}}{H_{y + 2}} + (x + \dfrac{y}{4} + 1,5){O_2} \to (x + 1)C{O_2} + \dfrac{{y + 2}}{2}{H_2}O\)
b mol (x + 1)b mol
\(xa + (x + 1)b = \dfrac{{8,8}}{{44}} = 0,2(3)\)
Từ (3), ta có x(a + b) + b = 0,2 → b = 0,2 - 0,03x
Vì 0 < b < 0,03 nên 0 < 0,2 - 0,03x < 0,03.
→ 5,67 < x < 6,67 → x = 6 .
b = 0,2 - 0,03.6 = 0,02; a = 0,03 - 0,02 = 0,01
Thay giá trị của a và b vào (2), tìm được y = 6.
Khối lượng C6H6 chiếm \(\dfrac{{0,01.78}}{{2,62}}\). 100% = 29,8%.
Khối lượng C7H8 chiếm 100 - 29,8% = 70,2%.
10. Giải bài 7.10 trang 52 SBT Hóa học 11
Cho 23 kg toluen tác dụng với hỗn hợp gồm 88 kg axit nitric 66% và 74 kg axit suníuric 96%. Giả sử toluen được chuyển hoàn toàn thành trinitrotoluen và sản phẩm này được tách hết khỏi hỗn hợp axit còn dư. Tính:
1. Khối lượng trinitrotuluen thu được.
2. Khối lượng hỗn hợp axit còn dư và nồng độ phần trăm của từng axit trong hỗn hợp đó.
Phương pháp giải
1. Tính theo PTHH
2. Sử dụng công thức: \(C\% = \dfrac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}} \times 100\% \)
Hướng dẫn giải
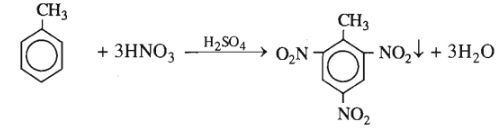
1. Số mol TNT = số mol toluen = \(\dfrac{{{{23.10}^3}}}{{92}}\) = 250 (mol).
Khối lượng TNT = \(\dfrac{{250.227}}{{{{10}^3}}} = {5675.10^{ - 2}}\) (kg).
2. Khối lượng hỗn hợp axit còn lại sau phản ứng :
23 + 88 + 74 - \({5675.10^{ - 2}}\) = \({12825.10^{ - 2}}\) (kg)
Khối lượng HNO3 trong đó : \(\dfrac{{88.66}}{{100}} - {3.25.10^{ - 2}}.63 = {1083.10^{ - 2}}\) (kg).
C% của HNO3 là : \(\dfrac{{{{1083.10}^{ - 2}}}}{{{{12825.10}^{ - 2}}}}\). 100% = 8,4%.
Khối lượng H2SO4 là : \(\dfrac{{74.96}}{{100}}\) = 71 (kg).
C% của H2SO4 là : \(\dfrac{{71}}{{{{12825.10}^{ - 2}}}}.100\% = 55,4\% .\)
11. Giải bài 7.11 trang 52 SBT Hóa học 11
Có thể điều chế toluen bằng phản ứng đehiđro hoá - đóng vòng đối với heptan ở 500oC, 30 - 40 atm, chất xúc tác Cr2O3 / Al2O3.
1. Viết phương trình hoá học của phản ứng (các chất hữu cơ viết bằng công thức cấu tạo).
2. Tính khối lượng toluen thu được nếu phản ứng tạo ra 336 lít H2 (đktc).
Phương pháp giải
1. Học sinh viết PTHH
2. Tính theo PTHH → số mol toluen theo số mol H2 → Khối lượng toluen thu được.
Hướng dẫn giải
1. CH3−[CH2]5−CH3 → C6H5CH3 + 4H2 (đk: Cr2O3/Al2O3, 30-40 atm, 500oC)
2. Số mol toluen = 1/4 số mol H2 = 336 : (4.22,4) = 3,75 (mol).
Khối lượng toluen là: 3,75.92 = 345 (g).
