Giải bài tập SBT Hóa 11 Bài 40: Ancol
Lời giải chi tiết và chính xác cho 11 bài tập trang 61,62 SBT Hóa lớp 11 đã được eLib sưu tầm và tổng hợp dưới đây sẽ giúp các em học tập thật tốt chuyên đề Ancol. Mời các bạn tải về tham khảo chuẩn bị cho bài học sắp tới.
Mục lục nội dung
1. Giải bài 8.7 trang 60 SBT Hóa học 11
2. Giải bài 8.8 trang 60 SBT Hóa học 11
3. Giải bài 8.9 trang 60 SBT Hóa học 11
4. Giải bài 8.10 trang 61 SBT Hóa học 11
5. Giải bài 8.11 trang 61 SBT Hóa học 11
6. Giải bài 8.12 trang 61 SBT Hóa học 11
7. Giải bài 8.13 trang 61 SBT Hóa học 11
8. Giải bài 8.14 trang 61 SBT Hóa học 11
9. Giải bài 8.15 trang 61 SBT Hóa học 11
10. Giải bài 8.16 trang 62 SBT Hóa học 11
11. Giải bài 8.17 trang 62 SBT Hóa học 11
12. Giải bài 8.18 trang 62 SBT Hóa học 11

1. Giải bài 8.7 trang 60 SBT Hóa học 11
Trong các chất dưới đây, chất nào là ancol ?
A. .png)
B. .png)
C. 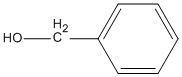
D. CH3−CH2−O−CH3
Phương phải giải
- Xem lại lí thuyết về Ancol
- Ancol là những hợp chất hữu cơ mà phân tử có nhóm hiđroxyl (-OH) liên kết trực tiếp với nguyên tử cacbon no, công thức R(OH)n
Hướng dẫn giải
Trong các chất trên ancol là

Đáp án C
2. Giải bài 8.8 trang 60 SBT Hóa học 11
Chất sau có tên là gì ?
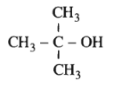
A. 1,1-đimetyletanol
B. 1,1-đimetyletan-1-ol
C. isobutan-2-ol
D. 2-metylpropan-2-ol
Phương phải giải
+ Danh pháp gốc chức: Ancol + Tên gốc hidrocacbon + ic
+ Tên thay thế: số chỉ vị trí nhánh - tên nhánh - tên mạch chính - số chỉ vị trí nhóm - OH + ol
Hướng dẫn giải
Tên gọi của chất trên là 2-metylpropan-2-ol
Đáp án D
3. Giải bài 8.9 trang 60 SBT Hóa học 11
Ancol isobutylic có công thức cấu tạo như thế nào ?
A. CH3-CH2-CH(CH3)-OH
B. CH3-CH(CH3)-CH2-OH
C. CH3-C(CH3)2-CH3
D. CH3-CH(CH3)-CH2-CH2-OH
Phương phải giải
Xem lại lí thuyết về Ancol
Hướng dẫn giải
Ancol isobutylic có công thức cấu tạo là CH3-CH(CH3)-CH2-OH
Đáp án B
4. Giải bài 8.10 trang 61 SBT Hóa học 11
Trong số các ancol sau đây:
A. CH3-CH2-CH2-OH
B. CH3-CH2-CH2-CH2-OH
C. CH3-CH2-CH2-CH2-CH2-OH
D. CH3-CH2-CH2-CH2-CH2-CH2-OH
1. Chất nào có nhiệt độ sôi cao nhất ?
2. Chất nào có khối lượng riêng cao nhất ?
3. Chất nào dễ tan nhất trong nước ?
Phương phải giải
Xem lại lí thuyết về Ancol
- Các ancol từ C1 đến khoảng C12 ở điều kiện thường là chất lỏng, từ C1 đến C3 tan vô hạn trong nước.
- Nhiệt độ nóng chảy, nhiệt độ sôi, độ tan trong nước của ancol đều cao hơn so với các hiđrocacbon có khối lượng mol phân tử tương đương, do tạo được liên kết hiđro giữa các phân tử ancol với nhau và giữa các phân tử ancol với nước.
Hướng dẫn giải
1. Chất có nhiệt độ sôi cao nhất là: CH3-CH2-CH2-CH2-CH2-CH2-OH → Chọn D.
2. Chất có khối lượng riêng cao nhất là: CH3-CH2-CH2-CH2-CH2-CH2-OH → Chọn D.
3. Chất dễ tan nhất trong nước là: CH3-CH2-CH2-OH → Chọn A.
5. Giải bài 8.11 trang 61 SBT Hóa học 11
Trong số các phản ứng hoá học dưới đây, phản ứng nào là phản ứng oxi hoá - khử ?
A. 2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + 2H2O
B. C2H5OH + HBr → C2H5-Br + H2O
C. C2H5OH + 2Na → 2C2H5ONa + H2
D. 2C2H5OH → (C2H5)2O + H2O (đk: 140oC, H2SO4)
Phương phải giải
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
Hướng dẫn giải
C2H5OH + 2Na → 2C2H5ONa + H2 là phản ứng oxi hoá - khử vì có sự thay đổi số oxi hóa
Đáp án C
6. Giải bài 8.12 trang 61 SBT Hóa học 11
Viết phương trình hoá học của phản ứng thực hiện các biến hoá dưới đây, ghi rõ điều kiện của từng phản ứng:
Tinh bột (1)→ Glucozơ (2)→ Ancol etylic (3)→ Anđehit axetic.
Phương phải giải
Học sinh nắm vững kiến thức về các hợp chất để viết PTHH
Hướng dẫn giải
(1) (C6H10O5)n + nH2O Enzim→ nC6H12O6
(2) C6H12O6 Enzim→ 2C2H5OH + 2CO2
(3) C2H5OH + CuO (to) → C2H5OH + CuO
7. Giải bài 8.13 trang 61 SBT Hóa học 11
Từ ancol propylic và các chất vô cơ, có thể điều chế propen, propyl bromua, đipropyl ete. Viết phương trình hoá học của các phản ứng thực hiện các chuyển hoá đó.
Phương phải giải
Học sinh nắm vững kiến thức về các hợp chất để viết PTHH
Hướng dẫn giải
CH3−CH2−CH2−OH → CH3−CH=CH2 + H2O (đk: H2SO4, 170oC)
CH3−CH2−CH2−OH + HBr (to)→ CH3−CH2−CH2−Br + H2O
CH3−CH2−CH2−OH → CH3−CH2−CH2−O−CH2−CH2−CH3 + H2O (đk: H2SO4, 140oC)
8. Giải bài 8.14 trang 61 SBT Hóa học 11
Chất A là một ancol no mạch hở. Để đốt cháy hoàn toàn 0,35 mol A phải dùng vừa hết 31,36 lít O2 (đktc). Hãy xác định công thức phân tử, công thức cấu tạo và tên của A.
Phương phải giải
- Gọi CTPT của A: CnH2n+2Ox
- PTHH: \({C_n}{H_{2n + 2}}{O_x} + \dfrac{{3n + 1 - x}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
- Tính theo PTTH, lập phương trình biểu diễn x theo n.
- Biện luận n → x → CTPT của A.
- Viết CTCT của A.
Hướng dẫn giải
Ancol no mạch hở là \({C_n}{H_{2n + 2 - x}}{(OH)_x}\)
CTPT là CnH2n+2Ox.
Theo phương trình : 1 mol ancol tác dụng với \(\dfrac{{3n + 1 - x}}{2}\) mol \({O_2}\)
0,35 mol ancol tác dụng với \(\dfrac{{31,36}}{{22,4}}\) = 1,4 mol O2
\(\dfrac{{3n + 1 - x}}{2}\) = \(\dfrac{{1,4}}{{0,35}}\) = 4 \( \Rightarrow \) 3n + 1 - x = 8 → x = 3n - 7
Ở các ancol đa chức, mỗi nguyên tử cacbon không thể kết hợp với quá 1 nhóm OH
Vì vậy 1 \( \le \) x \( \le \) n.
1 \( \le \) 3n - 7 \( \le \) n
2,67 \( \le \) n \( \le \) 3,5 ; n nguyên → n = 3
→ x = 3.3 - 7 = 2.
Công thức phân tử : C3H8O2.
Các công thức cấu tạo :
CH2OH-CH2-CH2OH ( propan-1,3-điol )
CH3-CHOH-CH2OH ( propan-1,2-điol )
9. Giải bài 8.15 trang 61 SBT Hóa học 11
Chất X là một ancol không no đơn chức, phân tử có 1 liên kết đôi. Để đốt cháy hoàn toàn 1,45 g X cần dùng vừa hết 2,24 lít O2 (đktc). Xác định công thức phân tử, viết công thức cấu tạo và tên chất X.
Phương phải giải
- Gọi chất X có dạng CnH2n-1OH, CTPT là CnH2nO
- Viết PTHH: \({C_n}{H_{2n}}O + \dfrac{{3n - 1}}{2}{O_2} \to nC{O_2} + n{H_2}O\)
- Tính theo PTHH → n → CTPT
- Viết CTCT.
Hướng dẫn giải
Chất X có dạng CnH2n-1OH, CTPT là CnH2nO
\({C_n}{H_{2n}}O + \dfrac{{3n - 1}}{2}{O_2} \to nC{O_2} + n{H_2}O\)
Theo phưomg trình : Cứ (14n + 16) g X tác dụng với \(\dfrac{{3n - 1}}{2}\) mol O2
Theo đầu bài: Cứ 1,45 g X tác dụng với \(\dfrac{{2,24}}{22,4}\) = 0,1 (mol) O2.
\(\dfrac{{14n + 16}}{{1,45}} = \dfrac{{3n - 1}}{{2.0,1}} \Rightarrow n = 3\)
CTPT : C3H6O.
CTCT : CH2 = CH - CH2 - OH ( propenol )
10. Giải bài 8.16 trang 62 SBT Hóa học 11
Hỗn hợp M chứa hai ancol no, đơn chức, mạch hở kế tiếp nhau trong dãy đồng đẳng. Để đốt cháy hoàn toàn 35,6 g hỗn hợp M cần dùng vừa hết 63,84 lít O2 (đktc). Hãy xác định công thức phân tử và phần trăm về khối lượng của từng chất trong hỗn hợp M.
Phương phải giải
Cách 1:
- Giả sử trong 35,6 g hỗn hợp M có x mol CnH2n+1OH và y mol Cn+1H2n+3OH
- Viết PTHH: \({C_n}{H_{2n + 1}}OH + \dfrac{{3n}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
\({C_{n + 1}}{H_{2n + 3}}OH + \dfrac{{3n + 3}}{2}{O_2} \to (n + 1)C{O_2} + (n + 2){H_2}O\)
- Dựa vào dữ kiện đề bài lập hệ phương trình ẩn n, x, y.
- Giải và biện luận phương trình → x, y, n → CTPT và phần trăm về khối lượng của từng chất trong hỗn hợp M
Cách 2: Sử dụng phương pháp trung bình.
Hướng dẫn giải
Cách 1:
Giả sử trong 35,6 g hỗn hợp M có x mol CnH2n+1OH và y mol Cn+1H2n+3OH :
(14n + 18)x + (14n + 32)y = 35,6 (1)
\({C_n}{H_{2n + 1}}OH + \dfrac{{3n}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
x mol \(\dfrac{{3n}}{2}\)x mol
\({C_{n + 1}}{H_{2n + 3}}OH + \dfrac{{3n + 3}}{2}{O_2} \to (n + 1)C{O_2} + (n + 2){H_2}O\)
y mol \(\dfrac{{3n + 3}}{2}\)y mol
Số mol O2:
\(\begin{array}{l}
\dfrac{{3n{\rm{x}} + (3n + 3)y}}{2} = \dfrac{{63,84}}{{22,4}} = 2,85(mol)\\
\Rightarrow 3n{\rm{x}} + (3n + 3)y = 5,7\\
n{\rm{x}} + (n + 1)y = 1,9(2)
\end{array}\)
Nhân (2) với 14 : 14nx + (14n + 14)y = 26,6 (2')
Lấy (1) - (2') ta được 18x + 18y = 9
→ x + y = 0,5
Từ (2) : n (x + y) + y = 1,9 → y = 1,9 - 0,5n
0 < y < 0,5 → 0 < 1,9 - 0,5n < 0,5 → 2,8 < n < 3,8
→ n = 3 → y = 1,9 - 1,5 = 0,4 → x = 0,5 - 0,4 = 0,1.
%m (C3H7OH hay C3HsO): \(\dfrac{{0,1.60}}{{35,6}}\). 100%= 16,85%.
%m (C4H9OH hay C4H10O): 100% - 16,85% = 83,15%.
Cách 2.
Đặt công thức của 2 ancol là \({C_{\overline n }}{H_{2\overline n + 1}}OH\)
\({C_{\overline n }}{H_{2\overline n + 1}}OH + \dfrac{{3\overline n }}{2}{O_2} \to \overline n C{O_2} + (\overline n + 1){H_2}O\)
Theo phương trình : (14\({\overline n }\) + 18) g ancol tác dụng với \(\dfrac{{3\overline n }}{2}\) mol O2
Theo đầu bài : 35,6 g ancol tác dụng với 2,850 mol O2
\(\dfrac{{14\overline n + 18}}{{35,6}} = \dfrac{{3\overline n }}{{2.2,85}} \Rightarrow \overline n = 3,8\)
→ Hai ancol là C3H7OH (x mol) và C4H9OH (y mol)
\(\left\{ \begin{array}{l}
60{\rm{x}} + 74y = 35,6\\
\dfrac{{3{\rm{x}} + 4y}}{{x + y}} = 3,8
\end{array} \right. \Rightarrow x = 0,1;y = 0,4\)
Từ đó tính được phần trăm khối lượng từng chất (như ở trên).
11. Giải bài 8.17 trang 62 SBT Hóa học 11
Hỗn hợp A chứa 2 ancol no, đơn chức, mạch hở. Để đốt cháy hoàn toàn hỗn hợp A cần dùng vừa hết 3,36 lít O2 (đktc). Trong sản phẩm cháy, khối lượng CO2 nhiều hơn khối lượng H2O là 1,88 g.
1. Xác định khối lượng hỗn hợp A.
2. Xác định công thức phân tử và phần trăm khối lượng của từng chất trong A nếu biết thêm rằng hai ancol đó khác nhau 2 nguyên tử cacbon.
Phương phải giải
Cách 1:
- Hỗn hợp A gồm x mol CnH2n+1OH và y mol CmH2m+1OH
- Dựa vào dữ kiện đề bài lập hệ phương trình ẩn n, m, x, y.
- Giải và biện luận tìm n, m, x, y \( \to\) công thức phân tử và phần trăm khối lượng của từng chất trong A.
Cách 2: Sử dụng phương pháp trung bình.
Hướng dẫn giải
Cách 1:
1. Hỗn hợp A gồm x mol CnH2n+1OH và y mol CmH2m+1OH.
Khối lượng hỗn hợp A là :
(14n + 18)x + (14m + 18)y = 14 (nx + my) + 18(x + y)
\({C_n}{H_{2n + 1}}OH + \dfrac{{3n}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
x mol \(\dfrac{{3n}}{2}\)x mol nx mol (n + 1)x mol
\({C_m}{H_{2m + 1}}OH + \dfrac{{3m}}{2}{O_2} \to mC{O_2} + (m + 1){H_2}O\)
y mol \(\dfrac{{3n}}{2}\)y mol my mol (m + 1)y mol
Số mol O2 : \(\dfrac{3}{2}(n{\rm{x}} + my) = \dfrac{{3,36}}{{22,4}} = 0,15(mol) \Rightarrow n{\rm{x}} + my = 0,1(1)\)
Hiệu khối lượng của CO2 và của H2O :
44(nx + my) - 18[(n + 1)x + (m + 1)y] = 1,88
26(nx + my) - 18(x + y) = 1,88 (2)
Từ (1) và (2), tìm được : x + y = 0,04.
Khối lượng hỗn hợp A là : 14.0,1 + 18.0,04 = 2,12 (g).
2. Vì m = n + 2 ; ta có : nx + (n + 2)y = 0,1
→ n(x + y) + 2y = 0,1 → y = 0,05 - 0,02n
0 < y < 0,04 → 0,5 < n < 2,5
Nếu n = 1, hai ancol là CH3OH và C3H7OH
→ y = 0,03 và x = 0,01
→ CH3OH chiếm 15,1% và C3H7OH chiếm 84,9% khối lượng hỗn hợp A.
Nếu n = 2, hai ancol là C2H5OH và C4H9OH
→ y = 0,01 và x = 0,03
→ C2H5OH chiếm 65,1%, C4H9OH chiếm 84,9% khối lượng hỗn hợp A.
Cách 2:
1. Công thức chung của hai ancol là \({C_{\overline n }}{H_{2\overline n + 1}}OH\) và tổng số mol của chúng là a. Khối lượng hỗn hợp : (14\(\overline n \) + 18)a.
\({C_{\overline n }}{H_{2\overline n + 1}}OH + \dfrac{{3\overline n }}{2}{O_2} \to \overline n C{O_2} + (\overline n + 1){H_2}O\)
a mol \(\dfrac{{3\overline n }}{2}\)a mol \({\overline n }\)a mol \((\overline n + 1)\)a mol
\( \Rightarrow \left\{ \begin{array}{l}
\dfrac{{3\overline n }}{2}a = 0,15\\
44\overline n a - 18(\overline n + 1)a = 1,88
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
\overline n = 2,5\\
a = 0,04
\end{array} \right.\)
Khối lượng hỗn hợp : (14.2,5 + 18).0,04 = 2,12 (g)
2. n < 2,5 < n + 2 \( \Rightarrow \) 0,5 < n < 2,50
Phần cuối giống như ở cách giải 1.
12. Giải bài 8.18 trang 62 SBT Hóa học 11
Hỗn hợp A chứa glixerol và một ancol đơn chức. Cho 20,3 g A tác dụng với natri (lấy dư) thu được 5,04 lít H2 (đktc). Mặt khác 8,12 g A hoà tan vừa hết 1,96 g Cu(OH)2. Xác định công thức phân tử, các công thức cấu tạo có thể có, tên và phần trăm về khối lượng của ancol đơn chức trong hỗn hợp A.
Phương phải giải
- PTHH: 2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2 Cu + 2H2O
- Tính theo PTHH → số mol glixerol trong 8,12 g A → Số mol glixerol trong 20,3 g A
- Tính khối lượng R-OH trong 20,3g A.
- Pt phản ứng với Na:
2C3H5(OH)3 + 6Na → 2C3H5(ONa)3 + 3H2
2R-OH + 2Na → 2R-ONa + H2
- Tính theo PTHH → khối lượng mol của R-OH → R → CTPT
- Viết các CTCT và gọi tên.
Hướng dẫn giải
Khi 8,12 g A tác dụng với Cu(OH)2 chỉ có 1 phản ứng hoá học :
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2 Cu + 2H2O
đồng(II) glixerat
Số mol glixerol trong 8,12 g A = 2.số mol Cu(OH)2 = 2.\(\dfrac{{1,96}}{{98}}\) =0,04 (mol).
Số mol glixerol trong 20,3 g A là: \(\dfrac{{0,04.20,3}}{{8,12}} = 0,1(mol)\).
Khối lượng glixerol trong 20,3 g A là : 0,1.92 = 9,2 (g).
Khối lượng R-OH trong 20,3 g A là : 20,3 - 9,2 = 11,1 (g).
Khi 20,3 g A tác dụng với Na có 2 phản ứng hoá học
2C3H5(OH)3 + 6Na → 2C3H5(ONa)3 + 3H2
0,1 mol 0,15mol
2R-OH + 2Na → 2R-ONa + H2
x mol 0,5x mol
Số mol H2 = \(0,15 + 0,5{\rm{x}} = \dfrac{{5,04}}{{22,4}} = 0,225(mol) \Rightarrow x = 0,15\).
Khối lượng 1 mol R-OH : \(\dfrac{{11,1}}{{0,15}} = 74(g)\).
R-OH = 74 → R = 74 - 17 = 57 ; R là - C4H9
CTPT: C4H10O
Các CTCT và tên :
CH3 - CH2- CH2 - CH2 - OH ( butan-1-ol)
CH3-CH2-CH(CH3)-OH (butan-2-ol)
CH3-CH(CH3)-CH2-OH ( 2-metylpropan-1-ol)
CH3-C(CH3)2-OH (2-metylpropan-2-ol)
13. Giải bài 8.19 trang 62 SBT Hóa học 11
Đun một hỗn hợp 2 ancol no, đơn chức, mạch hở với H2SO4 ở 140°C, thu được 72 g hỗn hợp 3 ete với số mol bằng nhau. Khối lượng nước tách ra trong quá trình tạo thành các ete đó là 21,6 g. Xác định công thức cấu tạo của 2 ancol và khối lượng mỗi ancol phản ứng.
Phương phải giải
- Viết các PTHH:
CnH2n+1OH + HOCnH2n+1 → CnH2n+1−O−CnH2n+1 + H2O
CmH2m+1OH + HOCmH2m+1 → CmH2m+1−O−CmH2m+1 + H2O
CnH2n+1OH + HOCmH2m+1 → CnH2n+1−O−CmH2m+1 + H2O
- Số mol 3 ete = số mol H2O → Số mol mỗi ete.
- Dựa vào dữ kiện "thu được 72 g hỗn hợp 3 ete với số mol bằng nhau" => pt toán học ẩn m, n.
- Biện luận n, m → CTPT → Khối lượng của mỗi ancol
Hướng dẫn giải
Ta có:
CnH2n+1OH + HOCnH2n+1 → CnH2n+1−O−CnH2n+1 + H2O
CmH2m+1OH + HOCmH2m+1 → CmH2m+1−O−CmH2m+1 + H2O
CnH2n+1OH + HOCmH2m+1 → CnH2n+1−O−CmH2m+1 + H2O
Số mol 3 ete = số mol H2O = 21,6 : 18 = 1,2 mol
Số mol mỗi ete là 1,2 : 3 = 0,4 mol
Khối lượng 3 ete :
(28n + 18).0,4 + (28m + 18).0,4 + (14n + 14m + 18).0,4 = 72.0 ⇒ n + m = 3.
Vì n và m đều nguyên và dương nên chỉ có thể n = 1 và m = 2 (hoặc ngược lại).
Hai ancol là CH3-OH và CH3-CH2-OH.
Số mol mỗi ancol là 1,2 mol.
Khối lượng CH3-OH là: 1,2.32 = 38,4 (g).
Khối lượng C2H5OH là: 1,2.46 = 55,2 (g).
14. Giải bài 8.20 trang 62 SBT Hóa học 11
Hỗn hợp khí A chứa 2 anken kế tiếp nhau trong dãy đồng đẳng. Tỉ khối của A đối với khí nitơ là 1,35.
1. Xác định công thức phân tử 2 anken.
2. Nếu hiđrat hoá một lượng hỗn hợp A (giả sử hiệu suất là 100%) thì được hỗn hợp ancol B, trong đó tỉ lệ về khối lượng giữa ancol bậc một và ancol bậc hai là 43 : 50. Hãy cho biết tên và phần trăm về khối lượng của từng ancol trong hỗn hợp B.
Phương phải giải
1. Dựa vào tỉ khối hơi của A → Biểu diễn khối lượng mol 2 anken theo ẩn n → CnH2n < 37,8 < Cn+1H2n+2) → n → CTPT 2 anken.
2. Giả sử trong 1 mol hỗn hợp A có x mol C3H6 và (1 - x) mol C2H4
- Dựa vào dữ kiện "Tỉ khối của A đối với khí nitơ là 1,35" → x
- Khi hiđrat hóa hoàn toàn 1 mol A:
CH2 = CH2 + H2O → CH3 - CH2 - OH
0,3 mol 0,3 mol
CH3 - CH = CH2 + H2O → CH3 - CH2 - CH2 - OH
a mol a mol
CH3 - CH = CH2 + H2O → H3C-CH(OH)-CH3
(0,7 - a) mol (0,7 - a) mol
- Dựa vào dữ kiện "tỉ lệ về khối lượng giữa ancol bậc một và ancol bậc hai là 43 : 50" → a
- Hỗn hợp B gồm CH3 - CH2 - OH ; CH3 - CH2 - CH2 - OH và CH3CH(OH)-CH3
- Tìm số mol từng chất trong B → phần trăm về khối lượng của chúng.
Hướng dẫn giải
1. Hỗn hợp khí A chứa CnH2n và Cn+1H2n+2 với phân tử khối trung bình là : 1,35.28 = 37,8
→ CnH2n < 37,8 < Cn+1H2n+2
→ 14n < 37,8 < 14n + 14 → 1,70 < n < 2,70 → n = 2.
CTPT của 2 anken là C2H4 và C3H6.
2. Giả sử trong 1 mol hỗn hợp A có x mol C3H6 và (1 - x) mol C2H4 :
42x + 28(1 - x) = 37,8 → x = 0,7
Như vậy, trong 1 mol hỗn hợp A có 0,7 mol C3H6 và 0,3 mol C2H4.
Giả sử hiđrat hoá hoàn toàn 1 mol A :
CH2 = CH2 + H2O → CH3 - CH2 - OH
0,3 mol 0,3 mol
CH3 - CH = CH2 + H2O → CH3 - CH2 - CH2 - OH
a mol a mol
CH3 - CH = CH2 + H2O → H3C-CH(OH)-CH3
(0,7 - a) mol (0,7 - a) mol
Tỉ lệ khối lượng giữa ancol bậc I so với ancol bậc II :
\(\dfrac{{46.0,3 + 60{\rm{a}}}}{{60(0,7 - a)}} = \dfrac{{43}}{{50}} \Rightarrow a = 0,2\)
Hỗn hợp B gồm 0,3 mol CH3 - CH2 - OH ; 0,2 mol CH3 - CH2 - CH2 - OH và 0,5 mol H3C-CH(OH)-CH3
Có khối lượng tổng cộng là 55,8 g.
% về khối lượng etanol (ancol etylic) là : \(\dfrac{{0,3.46}}{{55,8}}.100\% = 24,7\% \)
% về khối lượng của propan-1-ol (ancol propylic) là : \(\dfrac{{0,2.60}}{{55,8}}.100\% = 21,5\% \)
Propan-2-ol (ancol isopropylic) chiếm: \(\dfrac{{0,5.60}}{{55,8}}.100\% = 53,8\% \)
Riêng câu 2 cũng có thể lập luận như sau :
Phần trăm khối lượng của ancol bậc II (ancol isopropylic):
\(\dfrac{{50}}{{43 + 50}}.100\% = 53,8\% \)
Vậy phần trăm khối lượng của 2 ancol bậc I là 46,2%.
Nếu dùng 1 mol A (37,8 g) thì lượng H2O là 1 mol (18 g) và khối lượng hỗn hợp B là 37,8 + 18, = 55,8 (g), trong đó 0,3 mol C2H4 tạo ra 0,3 mol ancol etylic.
Phần trăm khối lượng của ancol etylic là \(\dfrac{{0,3.46}}{{55,8}}.100\% = 24,7\% \) và của ancol propylic là 46,2% - 24,7% = 21,5%.
